ATOMI. L’atomo nella fisica: gli spettri, i quanti: primi modelli atomivi.
In quello che abbiamo fin qui detto rispetto alle vicende della teoria atomica ci siamo fermati intorno alla metà del Settecento per quel che riguarda l’atomo nella fisica (i conti fatti da Bernouilli). Il resto rappresenta essenzialmente uno sviluppo della teoria nell’ambito della chimica che, come già accennato, non aggiungeva molto alla soluzione del problema continuità – discontinuità proprio perché la chimica può prescindere dalle dimensioni degli atomi.
E’ interessante seguire per grandissime linee come si sviluppò il dibattito nell’ambito della fisica.
Quando abbiamo parlato di Aristotele come di un oppositore della teoria atomica, abbiamo forse dato l’impressione che negare l’esistenza degli atomi si esaurisse a quelle argomentazioni e che la marcia verso la conquista dell’atomo sia stata del tutto lineare, frutto di un cumulo di fatti e teorie che inevitabilmente dovevano portarci agli atomi. Le cose non stanno così: la conquista della discontinuità della materia ha avuto un cammino estremamente travagliato che molto spesso si è intersecato con questioni che a prima vista nulla avevano a che fare con l’argomento in discussione. In alcune epoche lo scontro tra i sostenitori della continuità della materia con gli atomisti è diventato addirittura drammatico coinvolgendo problemi filosofico – ideologici di grande trascendenza.
Il Settecento fu il secolo di Newton.
E tra i lavori di Newton, per ciò che ci riguarda, assume un carattere di estrema importanza la scoperta della legge di gravitazione universale. Due masse m1 ed m2 poste ad una distanza r si attraggono con una forza F data da:

dove G è una costante, detta costante gravitazionale, che vale G = 6,7 .10-11 N.m2/Kg2. Questa semplice relazione dice molto di più di quanto non si legga in essa. Innanzitutto l’azione che si esercita tra due masse avviene lungo la retta congiungente i centri delle due masse (azione rettilinea); quindi questa azione si esercita a distanza tra le masse, senza che nessun intermediario la trasmetta (azione a distanza); infine l’azione è istantanea nel senso ch non impiega tempo per relazionare tra loro due masse, e ciò vuol dire che l’azione si propaga con velocità infinita (azione istantanea). Ebbene, l’ammissione di questa legge non fu tanto pacifica. Un’altra scuola di pensiero, quella che faceva capo a Descartes prevedeva invece che le azioni non potessero aver luogo che per contatto, cioè da punto a punto. Sullo sfondo quindi del problema continuità – discontinuità della materia c’erano delle implicazioni più profonde che coinvolgevano il tipo di azione e, in qualche modo, l’atomismo si identificò con l’azione a distanza mentre i sostenitori della continuità della materia si schierarono con l’azione a contatto. E neanche a pensare che le cose fossero così semplici: in realtà i problemi erano molto più complessi e questa sorta di manicheismo da me introdotto non riguardava altri se non coloro che sempre nella loro vita hanno bisogno di schierarsi in modo acritico. E’ comunque utile mantenere questo schema a fini di brevità che ci siamo proposti.
I lavori di Newton, il suo metodo, la sua impostazione ebbero il sopravvento e, almeno per tutto il Settecento, si affermò l’azione a distanza e con essa si poté liberamente pensare all’esistenza di atomi indipendentemente dal fatto che essi fossero o meno necessari a spiegare un qualche fenomeno. A parte il lavoro di Bernouilli, del quale abbiamo parlato, e di altre speculazioni dello stesso tipo, a proposito dell’esistenza degli atomi, occorrerà attendere la fine del secolo per avere un altro problema alla soluzione del quale l’ipotesi atomica darà un qualche notevole contributo.
Che cos’è il calore ?
Dietro questa innocente domanda c’è una infinità di problemi di grande complessità.
Tra le varie teorie che si erano avanzate quelle fluidistiche, che prevedevano cioè essere il calore un fluido che passava da un corpo ad un altro, sembravano aver preso il sopravvento. Questo fluido, il calorico, doveva essere dotato di peso e, proprio l’esperienza della conservazione della massa di Lavoisier (come accennato), aveva dato ad esse un colpo mortale. Secondo la teoria fluidistica infatti un corpo, se scaldato, deve pesare di più di quando esso è freddo. Ebbene, data la conservazione della massa, niente del genere si verificava.
Fu Benjamin Thompson, il conte Rumford, che per la prima volta interpretò il calore, così come noi oggi facciamo, in termini dinamici. Egli era addetto alla foratura dei cannoni per il Duca di Baviera ed il forte attrito che i trapani esercitavano sopra i blocchi metallici produceva un notevole riscaldamento. Per raffreddare l’insieme di trapano e blocco metallico si poneva tutto in acqua; ciò che Rumford fece fu il mettere in relazione il numero dei giri che un trapano faceva con il riscaldamento che si produceva. E Rumford concluse che il calore non è altro che ciò che forniamo: noi forniamo movimento ed otteniamo calore, ebbene il calore è movimento.
Ritorna in primo piano l’ipotesi atomica elaborata da Bernouilli: il moto delle particelle che costituiscono la materia è legato alla trasmissione del calore. E fu H. Davy che nel 1812 realizzò una esperienza, di gran semplicità, nella quale rese manifesta l’equazione calore = movimento: strofinando tra di loro due pezzi di ghiaccio, questi ultimi fondono.
Alla fine del Settecento e nei primi anni dell’0ttocento tutta la fisica delle grandi Accademie ed Università si andava schierando con l’ipotesi atomica.
Ampére nel 1814 assegnò agli atomi un ruolo che fino ad allora non avevano avuto: da essi sono emanate le forze attrattive e repulsive che sono alla base della costituzione della materia. Ancora Ampére nel 1820 ipotizzò che la materia deve essere costituita da molecole formate da un nucleo centrale intorno a cui ruotano delle correnti microscopiche.
Laplace era certamente schierato con l’ipotesi atomica e con lui tutti i grandi della scuola dei fisici matematici francesi. E’ comunque un essere schierati senza aggiungere nulla che faccia crescere l’ipotesi atomica.
Viceversa, in sordina, verso la fine del Settecento viene avanzata una teoria da parte del padre gesuita G.R. Boscovich che avrà importanti sviluppi sulla strada della negazione della discontinuità della materia. Secondo Boscovich gli ultimi costituenti la materia, i supposti atomi, debbono essere considerati come punti inestesi (privi di dimensioni ma dotati di massa) intorno ai quali vi sono delle atmosfere di forza. Questi punti-atomi sono soggetti alle tre leggi della dinamica; essi possono attrarsi o respingersi a seconda della distanza che li separa. Gli atomi di Boscovich sono una sorta di palline di gomma che quando vanno ad urtarsi si compenetrano un poco prima di respingersi. E proprio quest’ultima fu la motivazione che spinse Boscovich ad elaborare la sua teoria:
secondo tutte le precedenti elaborazioni gli atomi dovevano essere delle sferette rigide; quando due sferette di questa natura vanno a collidere , al momento dell’urto, si avrà una discontinuità nella loro quantità di moto (ad un dato istante, le quantità di moto delle due sferette saranno dotate di una data direziono e verso; nello stesso istante, quello dell’urto, le stesse palline avranno quantità di moto dirette allo stesso modo ma con versi opposti, naturalmente si parla di urto centrale); tatto ciò non si verifica nell’ipotesi di atomi che sono parzialmente compenetrabili poiché la quantità di moto dei due non si annulla di colpo per cambiare istantaneamente verso, ma gradualmente va ad annullarsi per poi gradualmente riassumere lo stesso valore ma in verso opposto.
Questa teoria aveva il pregio di conciliare, in qualche modo, il punto di vista della continuità (le forze sono ovunque presenti) con quelle della discontinuità (i punti inestesi). Essa inoltre si prestava molte bene ad una trattazione matematica e permetteva di spiegare tutte le proprietà e qualità della materia partendo dal punto inesteso come costituente comune della materia stessa (in pratica si aveva a che fare con un solo tipo di atomo che combinandosi variamente ed oscillando continuamente intorno alla sua posizione di equilibrio permetteva il formarsi delle varie sostanze con le diverse proprietà chimiche e fisiche). E’ interessante vedere una curva di forza tra due punti atomi di Boscovich perché in essa sono previste forze alternativamente attrattive e repulsive :

Il finire del Settecento è caratterizzato dal lavoro di un grande pensatore, I. Kant, che ebbe grandi influenze sugli sviluppi futuri della ricerca scientifica. In particolare a Kant si ispirava Schelling, il fondatore di unmovimento di pensiero, la Naturphilosophie, al quale si richiamerà il fisico danese H.C. Oërsted. In breve, secondo Schelling, la concezione di materia che si desume dall’ammissione di particelle dotate di massa ed in continuo movimento non rende ragione dell’esistenza della natura. Questa materia è un qualcosa di inerte finché su di essa non agiscono delle forze, entità diverse e separate dalla materia; ebbene ammettere questo dualismo è, seconde Schelling, ammettere una discontinuità tra materia e spirito che non corrisponde all’unità originaria di queste due entità, ad esempio, nell’organismo umano. Egli sosteneva quindi che è lo spirito (le forze) che si organizza in materia e poneva quindi le forze, agenti tra punti inestesi, con i loro conflitti e trasformazioni, alla base dell’esistenza del mondo. Non c’è più materia quindi, ma una particolare modificazione di una determinata zona dello spazio dovuta appunto ai conflitti ed alle trasformazioni delle forze eterne e preesistenti.
Sotto l’influenza di questo modo di intendere le cose e dopo nove anni di infruttuosi tentativi. Oërsted, con la sua famosa ed apparentemente innocente esperienza, riuscì a trovare forze disordinate nello spazio e comunquenon certamente riconducibili all’azione rettilinea e a distanza di Newton: l’azione che si esercita tra un filo percorso da corrente ed un ago magnetico disposto parallelamente al filo (l’ago ruota) è perpendicolare alla congiungente filo-ago e non è più riconducibile alle forze di tipo newtoniano.
Vi furono svariati tentativi per addomesticare l’esperienza di Oersted al fine di ricondurla alle ordinate forze della fisica di Newton. A questo fine lavorò soprattutto Ampére, ma anche Biot, Savart, e svariati altri.
L’esperienza di Oërsted trovò invece un fecondo interprete in Faraday.
La grandissima mole dei lavori sperimentali che portò a termine questo fisico britannico portarono alla conclusione che in qualche modo era stata adombrata da Boscovich: un punto inesteso circondato da una atmosfera di forza (il campo) che teoricamente si estende all’infinito è l’atomo di Faraday. Esso nasce per il fattoche Faraday è costretto ad ammettere l’esistenza di azioni a contatto e, conseguentemente, a negare le azioni newtoniane a distanza. Merito di Faraday fu quello di affermare definitivamente le azioni a contatto e cioè le azioni di campo. L’atomo sfumava in un qualcosa di non più riconoscibile dal punto di vista delle concezioni primitive proprio nel momento in cui era grandemente utilizzato nella chimica. E proprio da un fenomeno molto studiato dai chimici venne un indizio, all’epoca non colto, molto importante a favore della concezione atomica. Fu ancora Faraday che nel 1833 ricavò le sue famose leggi dell’elettrolisi: perché ad un elettrodo si liberi un grammoatomo di un elemento di valenza z, facente parte del composto in questione, la soluzione elettrolitica deve essereattraversata da una quantità di elettricità data da z volte 96.522 coulomb. Era il primo tangibile indizio della natura discontinua dell’elettricità, dell’esistenza dell’elettrone. Ma evidentemente era troppo presto perché daquesto indizio si potesse trarre una qualche conclusione.
Intanto negli stessi asmi (1827) il botanico britannico Robert Brown scoprì un fenomeno che avrebbe in seguito trovato una convincente spiegazione nell’ambito di uno degli assunti della teoria atomica: l’energia termica di un corpo è legata ai moti di minuscole particelle all’interno del corpo medesimo. Si tratta dei moti browniani, di fenomeni che riguardano i moti casuali a zig-zag che minuscole particelle in sospensione in un fluido eseguono. Come per l’altro indizio, quello dell’elettrone, bisognerà attendere vari anni prima che una esauriente spiegazione del fenomeno venga proposta (Einstein e Smolusovskij – 1905).
Ancora in quegli anni si stavano studiando degli strani fenomeni che non si riusciva in alcun modo a comprendere: gli «spettri» originati da diverse sostanze quando erano bruciate ed osservate attraverso opportuni strumenti. Data la rilevanza di queste argomento per ciò che segue, soffermiamoci un poco su di esso.
Gli spettri.
Tutti dovrebbero conoscere la celebre esperienza di Newton della separazione della luce solare mediante un prisma di cristallo:

Della luce bianca (Sole o lampada ad incandescenza), uscente dalla fenditura F, quando attraversa un prisma P,viene scomposta nei colori che la compongono. Su di uno schermo si osserverà una zona illuminata in modo continuo con tutti i colori dell’arcobaleno a partire dal rosso (cui corrisponde la minima deviazione), fino al viola (cui corrisponde la massima deviazione (ad ogni colore corrisponde una data frequenza; maggiore è la frequenza di un dato colore, maggiormente esso risulta deviato). Ebbene, quella striscia illuminata con i vari colori si chiama spettro e, in particolare, spettro della luce bianca.
La scienza che studia gli spettri si chiama spettroscopia. Seguiamone le tappe principali
1802 – il britannico W.H. Wollaston (1766-1828), osservando lo spettro solare prodotto da un prisma, scopre l’esistenza di sette righe scure distribuite in modo irregolare (più oltre se ne scopriranno altre);

1814 – il tedesco J. Fraunbofer (1787-1826) osserva il fenomeno in modo più approfondito: conta 560 righe scure, scopre che una di queste righe (chiamata D, quella in corrispondenza del giallo che poi si scoprirà essere unadoppia riga) coincide con la doppia riga gialla del sodio (vedi oltre; Fraunhofer non sapeva ancora che quella doppia riga gialla era caratteristica del sodio: egli la otteneva osservando lo spettro prodotto da una candela, da una lampada ad elio e da una lampada ad alcool); costruisce la prima carta dello spettro solare, scopre nello spettro di Venere alcune righe presenti nello spettro del Sole, introduce i reticoli di diffrazione (che permettono di separare meglio la luce) con i quali realizza le prime determinazioni della lunghezza d’onda dei vari colori dello spettro;
1827-1855 – in questi anni si sommano diversi contributi ed in particolare: la scoperta della fotografia ad opera del francese J.P. Niepce (1765-1833); la scoperta dell’emissione di spettri da parte di solidi portati all’incandescenza, ad opera del britannico J.W. Draper (1811-1882);
1857 – il tedesco R.W. Bunsen (1811-1899) scopre che utilizzando il gas illuminante, installato nel suo laboratorio nel 1855, si ottiene una fiamma non molto luminosa ma ad alta temperatura e costruisce il becco Bunsen, con il quale si possono ottenere gli spettri dei soli corpi portati all’incandescenza senza interferenze da parte della fiamma che non ha un proprio colore specifico;
1859 – Kirchhoff e Bunsen gettano le basi della moderna spettroscopia, distinguendo con chiarezza la differenza esistente tra spettri di emissione e spettri di assorbimento: se sul becco si fa bruciare del sodio, lo spettro presenta due righe gialle che coincidono esattamente con le più brillanti delle linee oscure dello spettro del Sole (riga D); osservando poi lo spettro della luce solare lungo la cui traiettoria è interposto il becco con del sodio che brucia, non appare più la riga D nello spettro solare ed al suo posto vi sono le righe gialle del sodio; questo ultimo fenomeno si verifica solo quando la luce solare è molto attenuata, in caso contrario si continua a vedere la linea D; lo stesso fenomeno si può ottenere mantenendo costante l’intensità della luce solare e aumentando o diminuendo la temperatura della fiamma del becco. Da ciò Kirchhoff capì il significato dello spettro solare ed in particolare delle sue linee scure: la superficie del Sole emette radiazioni ( ) di tutti i colori e l’atmosfera di gas incandescenti del Sole (cromosfera e corona), molto meno calda della fotosfera, assorbe una parte delleradiazioni emesse dal Sole, ed assorbe quelle che sono emesse dagli elementi componenti l’atmosfera solare. Come dice Kirchhoff: “le fiamme colorate nei cui spettri si presentano linee brillanti e marcate [spettro di emissione: quello di figura è del sodio], indebolisce talmente i raggi del colore di queste linee

quando passano attraverso di esse, che in luogo delle linee brillanti compaiono linee scure [spettro di assorbimento: quello di

figura è ancora del sodio con la riga gialla di emissione che diventa nera in assorbimento quando si colloca dietro la fiamma una fonte di luce di sufficiente intensità e nel cui spettro mancano queste linee.
Concludo quindi che le linee scure dello spettro solare, che non sono prodotte dall’ atmosfera terrestre, nascono dalla presenza nella infuocata atmosfera del Sole, di quelle sostanze che nello spettro di una fiamma presentano le linee brillanti nella stessa posizione.” Ed in questo modo Kirchhoff e Bunsen riuscirono a stabilire la presenza sul Sole di alcuni elementi: confrontando le righe che compongono lo spettro solare con quelle, ottenute in laboratorio, per elementi noti (all’esistenza di un dato insieme di righe nello spettro corrisponde sempre la presenza di un dato elemento).
Altro fondamentale risultato ottenuto da Kirchhoff nello stesso anno è il cosiddetto principio di inversione secondo il quale una sostanza assorbe le stesse radiazioni che è in grado di emettere.
Per portare avanti le loro ricerche i due si servirono di uno spettroscopio, strumento da loro realizzato e costruito da K. A. von Steinheil (famoso costruttore di strumenti ottici) nel 1853.
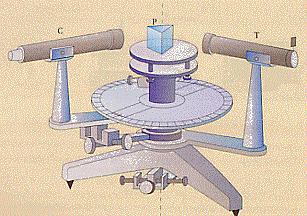
Sulla destra della figura vi è una fenditura regolabile in ampiezza da cui far passare la luce. La luce può essere quella di una lampada (luce bianca) o quella ottenuta con un becco Bunsen sul quale è sistemata una retina metallica sulla quale si mettono delle sostanze che si fanno bruciare per vederne gli spettri. Questa “luce” passa attraverso il collimatore T, va sul prisma P dove viene separata, quindi entra nel cannocchiale C (mobile su una ghiera graduata) ai cui estremi vi è un osservatore o una lastra fotografica (al posto di P, per avere studi più sofisticati si possono sistemare dei reticoli di diffrazione).
Gli studi in questo campo portarono a stabilire senza ombra di dubbio che ciascun elemento aveva un suo spettro che differiva da tutti gli altri. Se si aveva un composto, lo spettro che veniva fuori era semplicemente la sovrapposizione degli spettri dei vari elementi che lo costituivano. Per questa via si scoprirono nuovi elementi poiché in dati composti comparivano serie di linee che non erano mai state osservate per nessun elemento.
Esemplifico con gli spettri di due elementi, il primo dell’elio (elemento prima sconosciuto e che, appunto, fu trovato per via spettroscopica, analizzando lo spettro solare), il secondo del neon.


Ebbene, i dati osservativi stavano lì, avevano permesso importanti scoperte, ma non si riusciva a capire quale fosse l’origine degli spettri. Si provò a metterli dentro delle formule empiriche che rendessero conto della frequenza da assegnare ad ogni riga per differenti elementi. Nel 1885, lo svizzero Balmer riuscì a montare unaformula che rendeva conto della frequenza delle varie righe dello spettro dell’idrogeno (nel visibile). La formula di Balmer è:

dove B è una costante che vale 3,3.105s-1 ed n è il numero d’ordine della riga dello spettro dell’idrogeno della quale si vuole misurare la frequenza (si osservi che, nel visibile, sperimentalmente n va da 1 a 6).
Dallo studio della sua formula Balmer riuscì a prevedere alcuni fatti:
1) devono esistere delle righe relative ad n = 7, 8, 9, ……, ∞ nella regione dell’ultravioletto (queste righe furono osservate subito dopo con uno spettroscopio opportuno);
2) devono esistere relative ad 1/12 (nella formula) situate nel lontano ultravioletto (queste linee furono osservate sempre con uno spettroscopio opportuno da Lyman nel 1906: serie di Lyman);
3) devono esistere altre righe relative a 1/32 (nella formula) nella regione dell’infrarosso (queste righe furono osservate da Paschen nel 1908);
4) devono esistere altre righe relative a 1/42, 1/52, … nella regione dl lontano infrarosso (queste righe furono osservate negli anni seguenti da diversi ricercatori, tra cui Brackett e Pfund).
Ritorniamo all’atomo nella fisica.
La fine dell’Ottocento era piena di attività scientifica sperimentale e teorica. Sulla strada aperta da Faraday iniziò a muoversi Maxwell che, se da una parte sviluppò le idee di Faraday relative al campo e quindi ad una materia costituita da atomi evanescenti, dall’altra dette un enorme contributo alla teoria cinetica dei gas che non poteva in alcun modo essere trattata con gli atomi-campo. Questa strana situazione era abbastanza comune all’epoca: la trattazione dei fenomeni elettromagnetici doveva far ricorso alla teoria di campo, cioè all’azione a contatto, cioè a punti-atomi che non sembravano più avere le loro caratteristiche materiali; la trattazione dei fenomeni riguardanti la teoria cinetica e, più in generale, di quelli riguardanti la termodinamica trattata con metodi statistici, doveva far ricorso all’atomo materiale, alla minuscola pallina che rimbalzava incessantemente tra le pareti di un recipiente.
Intorno alla metà del secolo iniziarono le prime misure della velocità con cui le perturbazioni elettromagnetiche si propagavano nei cavi conduttori. E qui, pian piano, si riaffaccia un costituente della materia dalla natura corpuscolare: sarebbe un flusso di particelle cariche elettricamente che spostandosi da una parte all’altra, trasporta la perturbazione elettromagnetica. Queste particelle sono ancora del tutto indefinite: c’è chi pensa che questa corrente sia dovuta ad un solo flusso di particelle, cariche di un determinato segno, in un sol verso; c’è chi pensa si tratti di un doppio flusso contrapposto, in modo che le particelle cariche di un segno vanno in un verso mentre quelle di segno opposto vanno in verso opposto. Si susseguono moltissimi lavori teorici ma non si coglie ancora con chiarezza l’eventuale senso dell’ammissione di queste particelle cariche come costituenti la materia. In particolare se ancora di atomi si doveva parlare, visto che la materia è di per sé neutra e visto che eventualmente bisogna ammettere in essa delle particelle cariche, si dovrà ammettere, sempre in essa, la presenza di una carica di segno opposto che la renda neutra. Ed in ogni caso, se si deve parlare di atomi, bisogna cominciare a rinunciare al loro essere dei grani inscindibili.
Intanto, nel 1874, l’irlandese G. J. Stoney riprese il fenomeno dell’elettrolisi del quale Faraday aveva fornito la legge nel 1833. E sulla stessa strada si mosse anche Helmholtz nel 1881, con in più il grande vantaggio che l’autorità scientifica di Helmholtz era tale che una qualunque cosa egli sostenesse veniva subito presa in seria considerazione. Ebbene, sia Stoney che Helmholtz, mostrarono che se la materia e l’elettricità sono considerate discontinue (cioè formate da tante piccole particelle) allora gli esperimenti di Faraday sono semplici da spiegare.
Se ciascun atomo di materia, nel passare attraverso la soluzione, porta con sé una quantità di carica definita e ben determinata, allora la quantità di materia depositata su di un elettrodo sarà direttamente proporzionale a questa quantità di carica. Ora, un grammo-atomo di materia contiene un numero di atomi pari al numero N di Avogadro e quindi ciascun atomo trasporta una carica q pari a:
q = z.(96.522/N) coulomb
con z numero intero. Così la carica che ogni ione elettrolitico, di qualsiasi tipo esso sia, trasporta è sempre multipla di 96.522/N, che risulta quindi essere la carica elementare. A questa carica elementare Stoney, nel 1891, dette il nome di elettrone (agli inizi Stoney con la parola elettrone indicava la carica elettrica associata ad uno ione monovalente).
Alla possibile conclusione di esistenza di una carica elementare di elettricità si arrivò anche da una strada completamente diversa, quella dello studio della scarica nei gas rarefatti.
Nel 1879 il britannico W. Crookes, impegnato nello studio della scarica elettrica in gas rarefatti, sulla strada aperta fin dal 1751 da Watson e poi seguita da moltissimi ricercatori (Davy, Faraday, Abria, Geissler, Plücker, Hittorf, Karley, …) produce una scarica elettrica in un tubo di vetro in cui aveva praticato un vuoto molto spinto (dell’ordine di un millesimo di atmosfera). Da questa esperienza ricava l’esistenza dei raggi emessi dal catodo, costituiti, secondo la sua teoria, da molecole elettrizzate espulse dal catodo stesso (raggi catodici). Mentre anchealtri ricercatori , come E. Riecke, erano convinti della natura corpuscolare dei raggi catodici, alcuni, tra cui l’autorevole Hertz, non erano della stessa opinione.
Hertz, insieme al suo assistente Lenard, fece una serie di esperienze con i gas rarefatti. In particolare osservò (1892) che i raggi catodici erano in grado di attraversare sottili lamine metalliche. Da ciò egli concluse che non poteva trattarsi di fenomeni corpuscolari e che, al contrario, i raggi catodici non sono altro che delle vibrazioni dell’etere, allo stesso modo della luce.
Intanto Goldstein, servendosi di un catodo perforato, aveva scoperto l’esistenza dei raggi anodici, o positivi, o canale (1886); e Schuster era riuscito a misurare, anche se con scarsa precisione, il rapporto tra la carica e la massa delle ipotetiche particelle emesse dal catodo, osservandone la deviazione in un campo magnetico. .
Per rendere conto di una molteplicità di problemi teorici l’olandese H. A. Lorentz, nel 1892, elaborò una teoria degli elettroni nella quale l’elettricità era considerata un fenomeno di spostamento di particelle, gli elettroni, dotate di carica e di massa.
Da questo proto c’è un dato teorico da sottoporre alla prova dell’esperienza e le ricerche, appunto sperimentali si faranno sempre più frenetiche. Eccone una breve cronologia.
1894 – il britannico J.J. Thomson (1856-1940), usando di uno specchio ruotante, riesce a calcolare la velocità dei raggi catodici trovando un valore di circa 10.000 Km/sec, velocità molto più piccola di quella della luce edmenormemente più grande di quella delle molecole di un gas. Quindi, conclude Thomson, né Hertz né Crookes hanno ragione: non si tratta né di vibrazioni dell’etere né di molecole, ma di particelle d’altra natura e cariche negativamente;
1894 – P. Lenard dimostra che i raggi catodici possono uscire dal tubo di scarica, attraversando foglie sottili di alluminio come finestre e quindi diffondendosi nell’aria;
1895 – il tedesco W.C. Rontgen (1845-1923) scopre che, nelle vicinanze di un tubo di Crookes, le lastre fotografiche rimangono impressionate ed interpreta il fenomeno come originato da nuovi e misteriosi raggi provenienti dal tubo, che egli chiama raggi X;
1895 – il francese J. Perrin (1670-1941) dimostra che i raggi catodici sono costituiti da particelle cariche negativamente, gli elettroni;
1896 – Rontgen approfondisce lo studio dei raggi X scoprendo che essi sono generati da tutti i punti colpiti dai raggi catodici e che hanno la proprietà di scaricare i corpi elettrizzati;
1896 – il francese G. Gouy (1654-1926) scopre la rifrazione e la diffrazione dei raggi X;
1897 – J. J. Thomson dimostra che quando i raggi X passano attraverso un gas lo rendono conduttore di elettricità;
1897 – il tedesco K.F. Braun (1850-1918) dimostra che i raggi catodici sono deviati da un campo magnetico, ma anche da un campo elettrico e su questo principio costruisce un tubo (tubo di Braun), del tipo del tubo catodico di un televisore. Sul fondo del tubo è cosparsa sostanza fluorescente sulla quale si produce una piccola scintilla quando è colpita da un raggio catodico;
1897 – il tedesco W. Wiechert (l86l-1928) fornisce un’altra determinazione del rapporto tra massa e carica dell’elettrone, dalla deviazione dei raggi catodici sotto l’influenza di un campo magnetico e dal confronto dei dati così ottenuti con quelli che erano stati ottenuti mediante elettrolisi;
1897 – J.J. Thomson misura il rapporto e/m, tra carica e massa di un elettrone, trovando che esso vale 770 volte l’analogo rapporto per lo ione idrogeno;
1897 – il tedesco W. Kaufmann (1871-1947), usando il tubo di Braun, corregge in 1770 il valore trovato daThomson. Per le sue misure Kaufman si basa sempre sulla deviazione dei raggi catodici mediante campo magnetico ma anche sulla differenza di potenziale tra gli elettrodi.
A questo punto comincia a porsi il problema: se e/m calcolato per l’elettrone è tanto più grande del Q/M dello ione, ciò dipende dal fatto che è molto più grande di Q o dal fatto che è molto più piccolo di M ? Proprio allora il britannico C.T.R. Wilson ( 1869-1959) costruì uno strumento che permetteva di visualizzare le tracce delle particelle cariche (camera di Wilson o camera a nebbia).
1899 – J.J. Thomson, utilizzando una camera di Wilson, scopre che la carica di uno ione gassoso è la stessa dello ione idrogeno da fenomeni elettrolitici ed è anche la stessa di quelle particelle che vengono emesse da una superficie metallica per effetto fotoelettrico. Thomson trasse la conclusione che la carica dell’elettrone doveva essere uguale a quella dello ione idrogeno (che oggi sappiamo essere un protone), e di conseguenza era la massa m dell’elettrone che doveva essere molto piccola rispetto a quella di questo ione. Il valore che Thomson trovò per m era più piccolo di circa 1700 volte del valore della massa dello ione idrogeno. Questo valore fu in seguito perfezionato da ulteriori misure e mediante strumenti sempre più perfezionati.
Scoperta l’esistenza di una carica negativa costituente la materia e dato per scontato che la materia è neutra, si cominciò a porre il problema delle cariche positive che, all’interno della stessa materia, avrebbero dovuto neutralizzare le negative.
Altri fenomeni da campi diversi si accumulavano sulla strada dell’evidenza sperimentale dell’elettrone.
L’effetto fotoelettrico, scoperto casualmente da Hertz nel 1877, è uno di questi. Questo effetto, così come era stato scoperto, consisteva sella carica positiva che acquistava una determinata lastra metallica sottoposta ad una radiazione ultravioletta. Il fatto notevole è che l’effetto si produce solo per radiazioni da una data frequenza in su(frequenza di soglia) ed è indipendente dall’intensità della radiazione che colpisce la lastra metallica (non si ha l’effetto anche per elevatissime intensità di una radiazione che abbia frequenza inferiore a quella di soglia). Nel 1899 il tedesco Lenard ed il britannico J. J. Thomson comprendono che si tratta di elettroni emessi dalla superficie metallica (si noti che nel 1902 lo stesso Lenard affermò l’inconciliabilità di questo effetto con l’idea di energia che si propaga con continuità).
Altri fenomeni ancora si presentavano nella radioattività che, proprio sul finire del secolo, veniva scoperta.
Nel 1896 il francese H. Becquerel scopriva che alcuni sali di uranio riescono ad impressionare lastre fotografiche attraverso sostanze opache interposte. Dallo studio di questi fenomeni sia Becquerel che il britannico Rutherford ricavarono, nel 1899, che l’uranio emetteva due tipi differenti di radiazione con differenti proprietà elettriche e di penetrazione (i raggi a ed i raggi b). La conclusione cui arrivarono i due fisici era che si doveva trattare di radiazioni costituite da particelle dotate di carica. Appena un anno dopo (1900) P. Villard scoprì un terzo tipo di radiazione emessa dai sali di uranio con caratteristiche analoghe ai raggi X, (raggi g).
L’accumularsi di tutti questi fatti provenienti da fenomeni completamente diversi convinse i piùdell’esistenza dell’elettrone ma, fatto ancora più importante, mostrò che questo elettrone doveva essere un costituente comune di tutti gli atomi di tutti gli elementi.
Nel 1910, lo statunitense R. Millikan, migliorando alcuni apparati sperimentali realizzati precedentemente da J. J. Thomson, riuscì a misurare con una certa precisione la carica dell’elettrone, trovando:
e = 1,602 . 10-19 coulomb
Allo stesso modo si è riusciti più tardi (l911) a misurarne la massa:
me = 9,108 . 10-31 Kgm.
II secondo decennio del Novecento fu poi determinante per stabilire la realtà degli atomi. La scoperta dei raggi X, alla quale abbiamo accennato, permise a M. von Laue e quindi ai Bragg di passare allo studio dei cristalli facendoli attraversare da questi raggi. Ne risultarono effetti incredibili di interferenza, dallo studio (difficile) dei quali si poté risalire con certezza al fatto che essi sono costituiti da atomi disposti ai vertici di determinati reticoli, proprio quelli che empiricamente erano stati studiati precedentemente in mineralogia e teoricamente con l’uso della matematica.
I nfine, negli ultimi anni, la realizzazione del microscopio elettronico ci ha permesso di indagare ancora meglio la struttura cristallina arrivando quasi a percepire la presenza degli atomi (vedremo più oltre che c’è una impossibilità di principio di fotografare un atomo. A titolo di esempio, mostro una foto realizzata con un microscopio a campo ionico di una punta di una lega di platino iridio avvertendo che le figure che si vedono sono dovute alla diffrazione e che in nessun caso possono essere confusi con singoli atomi).

Tutto quanto abbiamo qui detto, in modo molto succinto, ha convinto dell’esistenza degli atomi. Ma,abbiamo già avvertito che le cose non sono così semplici; proprio sul finire del secolo scorso contro gli atomi fu scatenata una vera e propria crociata in nome di non vedo e quindi non credo. I motivi erano in realtà ben altri. Si era costruita un’equazione che voleva atomismo = meccanicismo = materialismo e, da contraltare, l’altra equazione che voleva inesistenza di materia = inesistenza di atomi = idealismo. La lotta fu durissima e per la verità, all’epoca fa vinta dagli antiatomisti (che facevano capo alla corrente filosofica dell’empiriocriticismo, più nota come neopositivismo) guidati dall’austriaco E. Mach e dal tedesco W. Ostwald.
Cercherò ora di dare un maggior ordine e sistematicità alla trattazione.
Allo scopo inizierò dallo studio dei primi modelli atomici che vennero proposti per rendere conto del fatto, già annunciato, che da una parte si erano individuate delle particelle negative come costituenti la materia e, dall’altra, quest’ultima risulta neutra.
I primi modelli atomici.
Già nel 1899, J. J. Thomson stava elaborando un qualche modello di atomo che rendesse conto dei fenomeni fisici osservati. Egli si rendeva conto che all’interno di un atomo doveva, in qualche modo, esservi della carica positiva. La presenza degli elettroni negativi nella materia doveva prevedere la presenza di un qualcosa di positivo che andasse a neutralizzare la carica di segno opposto. Ma su questa supposta carica positiva non si sapeva nulla. Fu Kelvin che nel 1901 suggerì che la carica positiva dovesse essere assegnata ad una massa omogenea e continua, da pensarsi come ordinariamente sono pensati i fluidi (una specie di massa gelatinosa a bassissima densità). Un atomo, allora, deve essere pensato come un continuo sferico di carica positiva dentro cui si trovano queste piccole masse che sono gli elettroni. Riguardo poi a come sono distribuiti gli elettroni nella gelatina positiva, dipende dal loro numero: se l’atomo ha un solo elettrone questo si dispone al centro della sfera;
se gli elettroni sono più di uno, probabilmente (dice Kelvin), si disporranno in superfici sferiche concentriche con la sfera ed interne ad essa. Questi elettroni saranno, inoltre, probabilmente dotati di moto rotatoriorio intorno al centro della sfera.
Quest’ultima eventualità, il moto rotatorio degli elettroni, creava però dei problemi con gli ultimi sviluppi dell’elettromagnetismo ed in particolare con i lavori di H.A. Lorentz del 1895 (sulla questione tornerò, con qualche dettaglio più oltre).
J. J. Thomson si mise a studiare il problema e nel 1904 portò a compimento il suo modello atomico servendosi di quanto Kelvin aveva sostenuto nel 1901. Tale modello atomico era pensato come costituito da una carica elettrica positiva distribuita uniformemente in una sfera piccolissima, neutralizzata da un conveniente numero di elettroni immersi nella stessa sfera e liberi di muoversi in essa:

Nel 1911 E. Rutherford, che era stato assistente di Thomson, suggerì, in base all’esperienza, che in un dato atomo la carica positiva e la maggior parte della massa fosse concentrata in un nucleo di dimensioni estremamente ridotte; la carica negativa, formata dagli elettroni è distribuita nel resto del volume atomico che risulta essere quindi in gran parte vuoto (se un elettrone atomico girasse intorno al Duomo di Milano, il nucleo non sarebbe più grande della capocchia di uno spillo).
Vediamo l’esperienza dalla quale Rutherford dedusse il suo modello atomico. Questa esperienza fu realizzata per la prima volta da Geiger e Mardsen nel 1909. I due fisici, allievi di Rutherford, stavano studiando le radiazioni emesse spontaneamente da un campione di radio con il seguente dispositivo sperimentale:

che consisteva di:
a) un campione S di radio le cui radiazioni sono schermate da due fogli F di piombo, a parte quelle che riescono a passare dalla fenditura;
b) una lamina d’oro L molto sottile (spessore ~ 10-6 cm) da far attraversare dalla radiazione;
c) degli schermi fluorescenti R (fatti ad esempio di solfuro di zinco) che quando sono colpiti da una particolare radiazione provocano una scintillazione localizzata che permette di individuare il punto di arrivo della radiazione stessa. Tali schermi o rivelatori potevano essere spostati tutt’intorno al sistema.
La pasticca del radio emette, fra l’altro, radiazioni a, cioè particelle formate tra l’altro da due protoni (nuclei di elio: He2+). Queste particelle escono a gran velocità dalla fenditura F e vanno ad urtare ed attraversare la lamina d’oro. A quell’epoca si aveva a disposizione il modello atomico di Thomson ed un pezzo di materia, costituito da questi atomi era pensato molto compatto (vedi la figura (a)):

La previsione era che la maggior parte delle particelle a, emesse dal radio riu scisse ad attraversare l’atomo (di Thomson): quelle che passavano per il centro non dovevano subire alcuna deviazione (nel qual caso, per motivi di simmetria, c’è equilibrio fra le forze repulsive agenti su di esse, quelle che passavano un poco più distanti dal centro dovevano essere deviate di angoli piccolissimi, aumentando la deflessione all’aumentare della distanza dal centro dell’atomo.

In definitiva si doveva trovare che poche particelle risultassero non deviate, mentre la gran parte dovesse risultare deviata.
I risultati che furono trovati dall’esperienza furono del tutto diversi. Si trovò infatti che le particelle a venivano deviate sempre di più quanto più passavano vicine al centro dell’atomo finché, quando passavano nel centro, venivano riflesse totalmente indietro. Si trovò cioè che la maggior parte delle particelle attraversava indisturbata (senza cioè alcuna deviazione) la lamina d’oro mentre le rimanenti altre subivano delle forti deviazioni e addirittura delle riflessioni all’indietro.
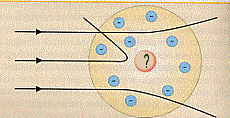
Questo fatto, apparentemente sorprendente, si poteva spiegare solo in un modo: all’interno dell’atomo c’era una forte concentrazione di carica positiva che determinava la repulsione delle particelle a . E questa fu la spiegazione che diede Rutherford: l’intera carica positiva, in luogo di essere diluita in tutto lo spazio occupato dall’atomo, è concentrata in un nocciolo (il nucleo) al centro dell’atomo.
In questa esperienza le cariche negative (gli elettroni) non disturbavano, infatti il loro comportamento è analogo a quello delle molecole d’aria quando sono attraversate da un proiettile: si spostano. La più grossa conseguenza di questa osservazione è che gli atomi sono in gran parte costituiti da spazio vuoto: la materia è costituita da più vuoti che pieni
I risultati conseguiti con le esperienze sulle particelle a diffuse da una lamina d’oro convinsero Rutherford a formulare un nuovo modello atomico. [Si osservi che per spiegare alcuni fatti sperimentali relativi agli spettri di emissione di alcune sostanze, nel 1903, il fisico giapponese H. Nagaoka (1865-1950) propose alla società fisicomatematica di Tokio m modello atomico costituito da un nucleo centrale positivo circondato da particelle cariche negativamente (gli elettroni) disposte in cerchio intorno al nucleo, a distanze uguali tra di loro. Il lavoro di Nagaoka fu pubblicato neli 1904 sulla rivista britannica Nature e, come si vedrà, il modella atomico di Rutherford coincide praticamente con quello di Nagaoka]. In definitiva, secondo Rutherford, si ha un nucleo positivo immerso in una atmosfera poco densa di elettroni, o meglio, si ha un si stema solare in miniatura con il nucleo centrale ed un certo numero di elettroni che gli ruotano intorno trattenuti dall’attrazione coulombiana, così come i pianeti ruotano intorno al Sole, sottoposti all’attrazione gravitazionale. Alla periferia dell’atomo, questi elettroni negativi neutralizzano l’effetto della carica positiva del nucleo; così che, complessivamente, l’atomo è neutro . Questo significa che il nucleo ha un numero di cariche elementari positive uguale al numero degli elettroni. Osservo a parte che Rutherford ha scoperto il nucleo dell’atomo . Nella figura riportata poco prima: in (a), come abbiamo visto, era rappresentato un pezzo di materia costituito con atomi di J. J. Thomson, osserviamo ora che in (b) è riportato lo stesso pezzo di materia costituito con atomi di Rutherford: è evidente la profonda differenza tra i due modelli.

Questo modello atomico di Rutherford non resse però che poco tempo alla prova teorica. Esso presentava infatti delle gravi incongruenze, ed in particolare con la teoria elettromagnetica di Lorentz, come abbiamo già accennato. Secondo questa teoria, infatti, ogni accelerazione del movimento di un elettrone dà origine ad un’onda elettromagnetica che irradia energia proporzionalmente al quadrato dell’accelerazione; soltanto nel moto uniforme una carica non irradia energia. In definitiva, quando si ha una carica elettrica in moto accelerato, essa deve irradiare energia nello spazio circostante sotto forma di onde elettromagnetiche. Ebbene, gli elettroni planetari sono delle particelle cariche le quali, per di più, muovendosi di moto rotatorio, sono dotate di accelerazione centripeta. Questa emissione di radiazione sottrae energia e quindi, per il principio di conservazione dell’energia, l’ energia meccanica dell’elettrone deve via via decrescere e, di conseguenza, la sua orbita gradualmente restringersi, finché esso cade sul nucleo; e tutto ciò in un tempo brevissimo, dell’ordine di 10-10 secondi. Questo fatto comportava l’instabilità dell’edificio atomico: ogni pezzo di materia avrebbe dovuto implodere su se stessa in tempi brevissimi ed il mondo sparirci davanti.
E questa non era l’unica difficoltà che comportava il modello di Rutherford. Un’altra ne nasceva proprio dal confronto del possibile comportamento degli elettroni in questo modelle con i fatti sperimentali che offriva la spettroscopia. Poiché gli elettroni potevano muoversi intorno al nucleo su ogni possibile orbita, questi elettroni dovevano possedere un continuo di valori di energia a partire da quella spettante alla prima orbita vicina al nucleo fino ad arrivare a quella corrispondente al livello di ionizzazione (quando cioè l’elettrone ha acquistato tanta energia da andarsene via dall’atomo cui appartiene). Guardando allo spettroscopio la radiazione emessa da siffatti atomi (quando sono eccitati) si dovrebbe vedere uno spettro continuo (analogo a quello della luce solare che passa attraverso un prisma) poiché gli elettroni possono avere tutte le possibili energie. Come già sappiamo questa ipotesi contrastava con l’esperienza che fino ad allora si era acquisita attraverso l’osservazione degli spettri di diversi atomi eccitati. Gli spettri atomici risultavano infatti costituiti da righe colorate separate da buio e non da un continuo di diversi colori.
Un’altra difficoltà era poi legala alla struttura intrinseca dei singoli atomi. Ci si chiedeva perché, dato il modello di Rutherford in cui gli elettroni potevano trovarsi su di un’orbita qualsiasi, due atomi di uno stesso elemento dovevano essere uguali? Perché gli elettroni di un atomo di carbonio dovrebbero muoversi sulle stesse, identiche, orbite di tutti gli altri atomi di carbonio?
Prima però di passare a vedere come furono sistemate le cose cerchiamo di illustrare quanto abbiamo detto a proposito della prima obiezione al modello atomico di Rutherford: perché una carica accelerata deve emettere energia.
Perché una carica accelerata irradia energia
Per capire perché un elettrone in un atomo debba irradiare energia elettromagnetica, cominciamo con il ricordare alcuni concetti di elettricità e magnetismo.
Una corrente elettrica è un flusso di cariche elettriche in moto. A questo flusso di cariche elettriche lungo un filo è associato un campo magnetico con le linee di forza circolari e concentriche al filo stesso:

Il campo magnetico B è tangente punto per punto a queste linee di forza con verso dato dalla regola di Maxwell o del cavatappi (il verso è quello di rotazione del cavatappi che avanza nel senso della corrente):

Supponiamo ora di avere una singola carica q in moto ( e l’elettrone è una carica). E’ spontaneo assumere che questa carica costituisca una piccolissima corrente elettrica lungo la linea su cui avanza la carica:

Sappiamo già che una carica elettrica ferma ha intorno a sé un campo elettrico E radiale (le linee di forza possono essere interpretate come i prolungamenti dei raggi della sferetta che ci rappresenta la carica):

Se questa carica si muove, poiché origina una piccolissima corrente elettrica, al campo elettrico si aggiungerà un campo magnetico le cui linee di forza saranno circonferenze concentriche alla linea del moto.
Questo campo magnetico risulterà essere trasversale (il vettore campo magnetico B è in ogni punto perpendicolare al vettore campo elettrico E); esso sarà nullo sulla linea del moto ed avrà il suo massimo sul piano perpendicolare a questa linea e passante per la carica.
I due campi, elettrico e magnetico, risultano così strettamente legati originando il cosiddetto campo elettromagnetico.
Consideriamo ora una carica elettrica che si muove di moto rettilineo uniforme (moto su di una retta con velocità costante). Questa particella, nel suo moto, trasporta con sé il campo elettromagnetico e l’energia che compete a questo campo. Supponiamo ora che la carica si sposti nel verso indicato in figura con velocità costante v:

Il campo elettrico della carica rimane invariato, mentre il campo magnetico: nei punti che sono dietro la carica (a sinistra della carica in figura) decresce gradualmente della stessa quantità, nei punti che sono davanti alla carica (a destra della carica in figura) cresce gradualmente della stessa quantità. In definitiva il campo elettromagnetico cresce gradualmente a destra della carica mentre decresce gradualmente, della stessa quantità a sinistra della carica. L’aumento di un campo significa un aumento dell’energia e viceversa per la diminuzione del campo, quindi, relativamente alla nostra carica in moto, si ha un continuo trasferimento di energia da sinistra verso destra o, più precisamente, nella direzione del moto. Si ha così un continuo flusso di energia nel verso del moto della carica.
Se si fanno i conti si vede che, data la simmetria dei campi elettrico e magnetico, non si ha irraggiamento di energia verso l’esterno, ma solo un trasferimento dell’energia nel verso del moto della carica. Ciò è comprensibile se si tiene conto che la carica vede intorno a sé, istante per istante, sempre lo stesso campo e quindi ha sempre una energia costante. Se questa energia è costante per la carica lo deve essere anche per un ipotetico osservatore.
In conclusione: una carica elettrica che si muove di moto rettilineo uniforme non irradia energia elettromagnetica verso l’esterno.
Consideriamo ora una carica che si muova di moto accelerato. Il campo elettrico di questa carica non è più radiale ma risulta dissimetrico con un addensamento delle linee di forza dalla parte verso cui si muove la carica:

Quando questa carica si muove non si avrà più la situazione vista precedentemente (aumento di campo a destra uguale alla diminuzione di campo a sinistra); ora il campo a destra crescerà di più di quanto diminuisca il campo a sinistra proprio a causa della accelerazione della carica e della conseguente dissimetria destra-sinistra del campo stesso. A questo aumento di campo corrisponde, come già sappiamo, un aumento di energia ed il bilancio destra-sinistra della carica in moto è tale per cui c’è un eccesso di energia risultante nella direzione del moto.
Questo eccesso di energia originato a spese della carica che crea il campo si trasferirà in tutto lo spazio circostante sotto forma di radiazione elettromagnetica.
In conclusione: una carica elettrica che si muove di moto accelerato irradia energia elettromagnetica verso l’esterno nello spazio circostante.
Se la carica q in considerazione si muove di moto accelerato (con accelerazione a) nel vuoto (e con buona approssimazione nell’aria), l’energia al secondo, W, che essa irradia (nel sistema MKSA) è data da (come ha ricavato Larmor intorno al 1900):
W = K.q2.a2
dove K è una costante che vale: K = 0,44.10-15 s/m, q è la carica elettrica, a è l’accelerazione che compete allacarica.
Nel caso in cui la carica sia quella e dell’elettrone, si ha:
W = K.e2.a2
ed essendo e = 1,6.10-19 coulomb, si ha:
W = G.a2
essendo G una costante che vale: G = K.e2 =1,13.10-53 (coulomb)2 s/m .
I quanti.
Premetto che nel sito vi è una discussione analitica che risale all’origine della teoria dei quanti. Qui tenterò una spiegazione meno fisica e più descrittiva. Inizio con quanto affermava un collaboratore di Einstein (che ebbe grandissima parte nello sviluppo di questa teoria), L. Infeld. Egli faceva l’esempio di una fabbrica, degli operai in essa impiegati, della produzione, ad esempio, di acciaio. Mentre l’energia in entrata, quella fornita dagli operai, è per sua natura discontinua, quella in uscita, l’acciaio lavorato, ha valori continui. Spieghiamoci meglio. Il lavoro in una fabbrica può essere realizzato da 1 o 2 o 3 o … 1000 operai, mai da 2,5 operai, mai cioè da una frazione di un operaio. Questi o sono rappresentati da numeri interi o non sono. Al contrario la produzione di acciaio può essere di 1000 tonnellate, di 1000,1 t, di 1000,2 t, …. di ogni possibile numero frazionario (o decimale) pensabile. Allo stesso modo, gli scambi energetici nel mondo macroscopico avvengono con continuità, mentre nel mondo microscopico possono avvenire solo per quantità discrete, per quantità che sono multiple di una quantità elementare. A questa quantità elementare fu dato il nome di quanto.
Si tratta di questo, così come abbiamo visto essere la materia costituita da piccole unità intere (non è pensabile un pezzo di rame fatto di un numero di atomi virgola qualcosa) chiamate atomi (ora non ci interessiamo della costituzione di un atomo, ma del fatto che un elemento è individuato da un dato atomo e solo da quello), Planck suppose che anche l’energia non potesse assumere tutti i possibili valori del continuo, ma solovalori ben determinati che, come detto, sono multipli di una unità elementare di energia.
In accordo con questa ipotesi, una sinusoide continua che rappresentava la luce nella vecchia visione, viene ora sostituita da tanti pezzi di sinusoide (vedi la figura esageratamente esemplificativa) o pacchetti di energia:

A ciascuna specie di radiazione (ad esempio verde, rosso, ecc…, per indicare solo radiazione visibile e luminosa) corrisponde una quantità definita di energia che viaggia separatamente in un tutt’uno, ed è così assurdo parlare di una frazione di un quanto di luce verde, come di una frazione di un atomo di rame. Planck assunse che i quanti di luce di differenti tipi di radiazione trasportano differenti quantità di energia e che la quantità di energia di unquanto di luce è direttamente proporzionale alla frequenza della radiazione o, che è lo stesso, inversamente proporzionale alla sua lunghezza d’onda. Indicando con n la frequenza della radiazione e con E l’energia del quanto di luce, possiamo esprimere l’ipotesi di Planck nella forma seguente:
E = h.n
dove h è un coefficiente di proporzionalità, conosciuto come costante di Planck, che ha, tra l’altro, la funzione di rendere omogenee energia e frequenza (la n è la lettera greca nu ed indica la frequenza della radiazione). La costante h ha un valore molto piccolo; essa vale
h = 6,62.10-27 erg.sec
Ed allora gli scambi di energia possono avvenire solo per quanti e ciò vuol dire che si possono scambiare 1,
2, 3, 230 quanti ma mai 1 quanto e mezzo: i mezzi quanti non esistono. Così le scambio di una data quantità energia potrà essere rappresentato dalla relazione:
E = n.h.n
dove (la prima n) è necessariamente un numero intero.
E che significa dire che l’energia che si scambia è direttamente proporzionale alla frequenza ? Per capiresupponiamo di illuminare, cioè di fornire energia ad un corpo con luce di differenti colori. Noi sappiamo che ad
un dato colore corrisponde una data frequenza, la più piccola per il rosso, la più grande per il viola (almeno per la luce visibile) e valori intermedi per il verde, il giallo, l’azzurro. Quindi illuminare con luce rossa un dato oggetto vuol dire che, a parità di intensità, della sorgente, si fornisce ad esso meno energia di quanta se ne fornirebbe se il medesimo oggetto lo illuminassimo con luce viola. In termini di quanti, ciò vuol dire che unquanto viola porta il massimo di energia (nell’ambito della luce visibile), un quanto indaco un poco meno, un
quanto azzurro ancora un poco meno, quindi, in questa scala, vi è il verde, poi il giallo, poi l’arancio ed infine il rosso.
Allora variare l’intensità di una sorgente luminosa vuol dire solo variare il numero di quanti che questa sorgente fornisce; variare invece la frequenza di una sorgente vuol dire variare il suo colore o, più in generale, la sua frequenza. Ed il fatto che macroscopicamente noi non avvertiamo questi salti quantici, ma avvertiamo una sensazione di continuo, è ben spiegabile: analogamente al fatto che la natura corpuscolare della materia non è percepibile ai nostri sensi, allo stesso modo per quel che riguarda la natura corpuscolare dell’energia. Un esempio banale può essere tratto dalla nostra vita quotidiana: quando verniciamo una superficie con una bomboletta spray abbiamo un colore compatto sulla superficie verniciata ma questo colore è il portato di tante piccole particelle che sono spinte fuori in modo certamente discontinuo. Per quanto ne so e per quanto mi pare, questo modo di vedere le cose sconvolse più i fisici formati ad una certa scuola che non coloro i quali apprendono questi fatti.
Per ricapitolare quanto fino ad ora detto per quel che ci servirà, gli scambi di energia avvengono per unità intere, i quanti, non è ammissibile la presenza di una frazione di quanto; ciascun quanto possiede una energia pari ad E = h.n; un dato oggetto può emettere o assorbire una quantità di energia multipla intera di hn.
L’atomo di Bohr
Nel 1913 il danese N. Bohr apportò alcune correzioni all’atomo di Rutherford in modo che esso potesse rispondere ai fatti sperimentali e fosse in grado di risolvere le gravi difficoltà cui esso si era scontrato (ed alle quali abbiamo accennato). Queste correzioni erano basate sull’accettazione della teoria dei quanti e sulla sua applicazione alla struttura degli atomi ma, come vedremo, sembravano del tutte ingiustificate da un punto di vista teorico.
Essenzialmente Bohr basò il suo modello atomico su due postulati non giustificati, se non per rendere conto dei fatti sperimentali, una specie di formula di Balmer a livelli molto superiori. Il primo di questi postulati, conseguenza diretta dell’applicazione dei quanti alla struttura atomica, afferma che in un atomo gli elettroni nonpossono assumere qualsiasi valore dell’energia ma solo certi valori definiti (si usa dire che in un atomo l’energia è quantizzata). Ciò significa qualcosa di molto importante: solo certe orbite elettroniche possono essere occupate dagli elettroni che ruotano intorno al nucleo e ad ogni orbita corrisponde un determinato valore dell’energia.
Questa prima ipotesi può essere formulata più precisamente nel modo seguente. Supponiamo di considerare un elettrone che ruoti intorno al nucleo su una determinata orbita; sia r il raggio dell’orbita che stiamo considerando e q= mv la quantità di moto dell’elettrone su questa orbita, di modo che il momento della quantità di moto, meglio, il momento angolare dell’elettrone rispetto al nucleo sarà p = mvr; ebbene, questo momento angolare non può assumere tutti i valori possibili, ma solo alcuni determinati , multipli interi di una data quantità elementare; vale cioè la relazione:
mvr = n(h/2p )
là dove n è un numero intero positivo chiamato numero quantico principale ed h è la costante di Planck.
II secondo postulato riconosce che l’elettrone orbitale non può emettere alcuna energia a meno che non cambi orbita (cioè livello energetico); questo passaggio non può avvenire, quindi, gradualmente, ma si ha un vero e proprio salto energetico. Quando, per un qualche motivo, un elettrone salta da una orbita ad energia più alta (livello energetico iniziale: i) ad una energia più bassa (livello energetico finale: f), la sua perdita di energia è emessa sotto forma di quanto di luce (oggi meglio conosciuto come fotone). Si ha così:
Ei – Ef = h n .
dove Ei è l’energia corrispondente all’orbita ad energia più alta, Ef quella corrispondente all’orbita ad energia più bassa ed hn (con n=frequeza della radazione) è il quanto di luce che abbiamo incentrato nella prima teoria dei quanti di Planck. La relazione scritta significa che un elettrone nel passare da una certa orbita ad una ad energia più bassa perde energia, e questa perdita di energia (per la legge di conservazione) la si ritrova sotto forma di emissione di radiazione (emissione di un quanto di radiazione). Nel caso il salto avvenga in senso contrario a quello descritto fin qui si ha assorbimento di un quanto di radiazione hn dall’esterno. [Noto a parte che la prova sperimentale dell’esistenza degli stati quantici fu fornita da Franck ed Hertz nel 1913].
Cerchiamo di vedere un poco più in dettaglio i conti che fece Bohr. In un atomo l’elettrone orbita circolarmente intorno al nucleo. La forza centripeta (Fcentripeta = Fc) che mantiene l’elettrone nell’orbita circolare è fornita dalla forza di attrazione elettrostatica (Felettrostatica = Fe) che il nucleo esercita sull’elettrone;
deve allora risultare:
Fc = Fe
La forza centripeta è data da:

La forza elettrostatica è data invece dalla formula:

dove: Z = numero atomico; K = 1/4πε0 ; ε0 = 8,85.10-12 coulomb2/N.m2; e = carica dell’elettrone = carica del protone = 1,6.10-19 coulomb. Si ha allora:
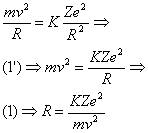
A questo punto subentra la condizione di Bohr di quantizzazione del momento angolare:

(con n = 0, 1, 2, …….., ∞) e, sostituendo la (2) nella (1) si ha:

e questo è il valore del raggio atomico R (vari R per vari n) per vari atomi (al variare di Z). Sostituendo la (3) nella (2) si ha:

e questa è la velocità tangenziale dell’elettrone per varie orbite (al variare di n) e per vari atomi (al variare di Z). se si fa un rapido calcolo per l’atomo di idrogeno (Z = 1) non eccitato (con l’elettrone nell’orbita n = 1)si trova che il raggio atomico vale R = 0,53 Å (angstrom), mentre la velocità dell’elettrone intorno al nucleo vale v = 2,182.108 cm/s. Osservando a questo punto che la velocità angolare w è data dalla velocità tangenziale v divisa per il raggio R, si trova:

Ritorniamo ora all’equazione (1)’ ed osserviamo che l’espressione mv2 rappresenta l’energia (nel nostro caso potenziale Ep, con il segno – perché attrattiva). Si ha allora:

Osserviamo inoltre che l’energia cinetica Ec è data da:
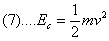
Ricordiamo ora che l’energia totale Et del livello n-esimo è data da:
Et = Ec + Ep
si ha, sostituendo a v la (4) e ad R la (3):

e questa è l’energia totale che compete ad un elettrone di un atomo con numero atomico Z, che si trovi sull’n-esima orbita.
Consideriamo ora due orbite elettroniche: una caratterizzata da n e l’altra da n1 (con n1 > n); l’energia totale della prima sarà En e della seconda En1 (con En1 > En):

Riferendoci all’atomo di idrogeno (Z = 1), si ha:


Per quanto già sappiamo e per la conservazione dell’energia si può scrivere:
En1 – En = hn .
Calcoliamo quanto vale la differenza al primo membro:

Osserviamo che la costante che moltiplica la parentesi è calcolabile per semplice sostituzione dei valori delle costanti che la compongono:
m = 9,1.10-31Kgm; massa dell’elettrone
e = 1,6.10-19coulomb; carica dell’elettrone
h = 6,6.10-34j.s; costante di Planck
ε0 = 8,85.10-12coulomb2/N.m; costante dielettrica del vuoto,
e si trova:

Introducendo una nuova unità per l’energia, l’elettronvolt ( 1 eV = energia che acquista un elettrone nel
passare attraverso la differenza di potenziale di 1 volt):
1 eV = 1,6.10-12erg => 1 erg = 6.1011eV
si ha che quella costante vale 13,6 eV. La (9) può quindi scriversi:

Vediamo la portata e la semplicità dell’espressione ricavata calcolando l’energia hn che occorre fornire all’elettrone dell’atomo di idrogeno per farlo passare dalla prima orbita (n = 1) alla seconda (n1 = 2):
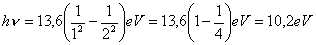
Vediamo ora qual è l’energia necessaria ad allontanare l’elettrone dall’atomo cui appartiene, a portarlo cioè dall’orbita n = 1 a quella n1 = ∞ (energia di ionizzazione):

La relazione (10), trovata da Bohr, spiegava bene le righe spettrali osservate la prima volta nel 1906 e relative ad n = 1. appunto in quell’anno Lyman osservò, con uno spettroscopio per radiazione ultravioletta (UV), uno spettro di radiazione, emesso dall’idrogeno, costituito da tante righe che andavano addensandosi intorno alla lunghezza d’onda di 908 Å (che corrisponde ad n1 = ∞), come mostrato in figura:

Già nel 1885 erano state osservate le righe spettrali dell’idrogeno situate nella regione del visibile (da 4.000 Å a 7.000 Å) e relative ad n = 2 (si veda figura):
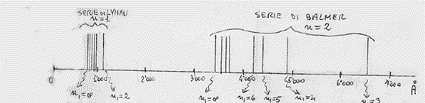
Quindi tutte le altre situate in altre regioni dello spettro. In definitiva, per quel che riguara il visibile si ritrova la formula che empiricamente aveva dato Balmer. E merito di Bohr fu proprio l’aver dato un significato a quella costante B che avevamo incontrato in quella formula. Inoltre la formula di Bohr era in grado di prevedere altri spettri a frequenze diverse e tutto questo fu confermato sperimentalmente (con una qualche deviazione al crescere di Z, come vedremo). Nella figure che seguono sono riportate tutte le serie spettrali dell’idrogeno:


I due postulati di Bohr forniscono un nuovo modello di atomo che è simile a quello di Rutherford con la fondamentale differenza che ora non tutte le orbite sono permesse all’elettrone (quantizzazione dell’energia o dei livelli energetici). In tal modo l’edificio atomico risulta stabile anche se con qualche difficoltà teorica. Non sto quia fare una storia dettagliata della messe di lavori che venne dopo quelli di Bohr. Ma occorre dire che questo modello atomico fu perfezionato da Sommerfeld nel 1916. Sommerfeld, per tentare di eliminare la non adesione ai dati sperimentali del modello per Z > 1 (ed anche alcune questioni legate all’intensità delle linee spettrali), applicò all’intero atomo una quantizzazione più spinta. Infatti la quantizzazione del momento angolare introdotta da Bohr limita i gradi di libertà di un elettrone costringendolo ad un raggio R di una determinata orbita.
Sommerfeld suppose che l’elettrone, muovendosi nello spazio ha tre gradi di libertà e non uno solo. Sviluppando matematicamente il concetto Sommerfeld introdusse tre numeri quantici (vedi più avanti), anziché il solo numero quantico n, come aveva fatto Bohr. Il primo numero quantico, n (quanto principale, che può assumere valori interi e positivi), come quello di Bohr, indica l’orbita su cui l’elettrone si muove (il suo livello energetico). Il secondo numero quantico, l (quanto azimutale, che può assumere valori interi e positivi), ci dà invece loschiacciamento delle orbite (queste non sono più circolari, come aveva indicato Bohr, ma possono anche essere ellittiche: più l è grande, più l’orbita è schiacciata o eccentrica).

Il terzo numero quantico, m* (quanto magnetico, che può assumere valori interi positivi e negativi), rende conto del fatto che il piano dell’orbita può avere solo certe determinate inclinazioni rispetto ad un asse di riferimento (quantizzazione spaziale).

Un’altra importante novità nella trattazione di Sommerfeld dell’atomo di Bohr è l’introduzione della teoria einsteniana della relatività (1905) per lo studio del movimento degli elettroni orbitanti intorno al nucleo. Gli elettroni planetari, infatti, si muovono a velocità molto vicine a quella della luce c (velocità della luce) ed a questa velocità è importantissimo introdurre la teoria della relatività che ci rende conto di altri fatti sperimentali altrimenti non spiegabili (la separazione dei livelli energetici, andando a studiare la struttura fine degli spettri degli atomi che consiste in un maggior numero di righe osservate se l’osservazione è fatta in modo più sofisticato, con uno strumento cioè in grado di separare linee che grossolanamente sembrano una sola. Nella figura seguente
si può vedere come, in struttura fine si separano le prime due righe della serie di Balmer e la prima di quella di Paschen).

La teoria di Bohr si può ulteriormente migliorare tenendo conto che quando si ha a che fare con un oggetto che ruota intorno ad un altro oggetto, bisogna considerare i due oggetti che ruotano intorno al loro centro di gravità.
Ciò vuol dire che in qualche modo bisogna tener conto anche della massa del nucleo e, in definitiva, occorre sostituire ad m che compare nelle formule viste la cosiddetta massa. ridetta (m) data da:

dove M è la massa del nucleo.
La teoria di Bohr (ed ormai di Bohr-Sommerfeld), come accennato, lasciava tuttavia a desiderare dal punto di vista logico, trattandosi in sostanza di una sovrapposizione di condizioni nuove alle vecchie leggi della meccanica, poiché si sceglievano, tra le orbite meccaniche, quelle che a tali condizioni si adattavano: si adattano le leggi classiche della meccanica e dell’elettromagnetismo per definire l’orbita dell’elettrone, leggi che venivano poi ripudiate quando si postulava che l’elettrone su un’orbita stazionaria (vedi oltre) non poteva irradiare, in pieno ed aperto contrasto con le leggi inizialmente ritenute valide. Inoltre si introducevano delle costanti arbitrarie (i numeri quantici) che erano un chiaro segno dell’insufficienza della teoria.
La meccanica ondulatoria
Nella relazione di Planck, E = hn, abbiamo visto che si lega l’energia portata da un quanto di luce (questa dizione è di Einstein) con la frequenza dell’onda di radiazione; questo fatto mostra la strana situazione in cui sitrovava la fisica agli inizi del novecento, di fronte a due teorie della luce assolutamente antitetiche ed inconciliabili (quella corpuscolare e quella ondulatoria), ciascuna delle quali però era necessaria per spiegare alcuni fenomeni non giustificabili con l’altra (il fenomeno dell’interferenza era spiegabile solo con la teoria ondulatoria mentre quello dell’effetto fotoelettrico solo con una strana teoria corpuscolare della luce – tra l’altroquesto fenomeno trovò spiegazione solo attraverso i quanti di luce di Einstein nel 1905).
La dualità onda corpuscolo, già ammessa per la luce, ha un compito essenziale per tutti i problemi in cui entra in gioco l’energia. Di qui l’idea fondamentale formulata nel 1923 dal fisico francese Louis de Broglie:
generalizzare la dualità precedente; associare cioè un’onda all’elettrone come a tutti i corpuscoli conosciuti.
Tale idea fu accettata ed estesa dal fisico austriaco Schrödinger a cui si deve una trattazione completa di tali onde, e fu il punto di partenza della celebre meccanica ondulatoria. La trattazione fatta da Schrödinger delle onde suddette conduceva agli stessi risultati di Bohr.
Prima di procedere, andando a meglio capire quanto qui sostenuto, è conveniente discutere brevemente della meccanica delle onde.
Le onde
Tutti abbiamo gettato, almeno una volta, un sasso nell’acqua. Abbiamo visto dei cerchi concentrici crearsi intorno al punto in cui il sasso era entrato in acqua. Abbiamo osservato che questi cerchi si allontanano, aumentando il loro diametro, da quel punto con una velocità costante. Sappiamo che quelle protuberanze sull’acqua si chiamano onde.
Facendo una sezione dello stagno centrata nel punto in cui il sasso è entrato in acqua, abbiamo la seguente figura (la parte tratteggiata rappresenta il piano dell’acqua prima del lancio del sasso: si vede quindi che

dell’acqua si innalza dal piano originale mentre altra acqua si abbassa rispetto a questo piano).
Consideriamo ora solo il profilo dell’onda:
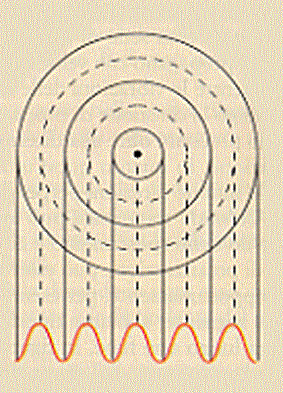
Come si vede vi sono dei punti in cui l’altezza dell’onda è massima (massimi) e dei punti in cui questa altezza è minima (minimi). La distanza tra due massimi o tra due minimi è chiamata lunghezza d’onda e si indica con λ. La semidistanza, perpendicolare alla precedente, tra un massimo ed un minimo è chiamata ampiezza dell’onda e si indica con A:

La velocità v dell’onda è la velocità con cui (rifacendoci all’esempio del sasso in acqua) un massimo (o un minimo) si allontana dal punto in cui è stato gettato il sasso in acqua:

Supponiamo ora di avere come punto di riferimento sul lo specchio d’acqua un filo d’erba che emerge a poca distanza dal punto in cui gettiamo il sasso. Chiameremo frequenza dell’onda e la indicheremo con n il numero di massimi (o di minimi) che passano, in un secondo, per il filo d’erba. In termini matematici la frequenza di un’onda è data dalla sua velocità divisa per la sua lunghezza (infatti la frequenza è tanto maggiore quanto più grande è la velocità dell’onda e tanto maggiore quanto è più piccola la lunghezza dell’onda): n = v/l.
Si potrebbe a questo punto fare un piccolo esperimento. Disponiamo di una bacinella molto larga e poco profonda. Riempiamo d’acqua questa bacinella e lasciamo che l’acqua formi uno specchio rimanendo perfettamente immobile. Poniamo a galleggiare sull’acqua un piccolo sughero. Se ora forniamo un impulso (p = F.t = m.v) al centro del piccolo specchio d’acqua (ad esempio colpendo la superficie dell’acqua con una matita
tenuta perpendicolarmente la superficie) si genereranno delle onde concentriche che via via si allontaneranno dal centro della bacinella per arrivare ai bordi. A questo punto potremo osservare che il nostro sughero, al passaggio dell’onda, si innalzerà e si abbasserà successivamente al passaggio dei massimi e dei minimi dell’onda ma non si sposterà dal punto dove si trova. Possiamo ripetere più volte l’osservazione, colpendo successivamente più volte la superficie dell’acqua con la matita, e troveremo sempre lo stesso risultato. L’impulso che noi abbiamo fornito all’acqua col pendolo lo ritroveremo dopo un poco di tempo ai bordi della bacinella ma il sughero è oscillato (trasversalmente) rispetto alla sua posizione di equilibrio senza spostarsi longitudinalmente.
Possiamo quindi iniziare a trarre una qualche conclusione: un’onda non trasporta materia ma energia.
Supponiamo ora di avere a disposizione due onde con stessa lunghezza d’onda che si propagano da uno stesso punto (nella figura sono riportate su piani diversi per rendere evidenti le due onde) se a massimi di un’onda corrispondono esattamente massimi dell’altra onda, si dice che le onde sono in fase;
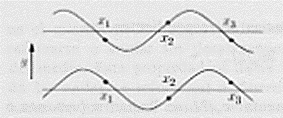
se non c’è alcuna corrispondenza tra massimi e minimi, le onde si dicono sfasate;

se infine ai massimi di un’onda corrispondono via via i minimi dell’altra, le onde si dicono in controfase (massimo sfasamento);

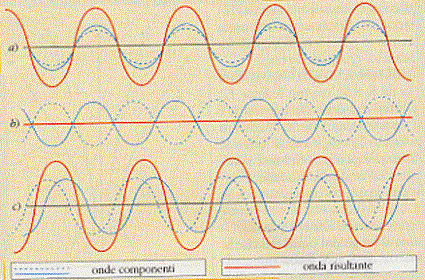
Vediamo come agiscono tra loro queste onde, vediamo qual è l’onda che si ottiene dalla somma algebrica tra le due.
Se le due onde sono in fase si sommano tra loro originando un’onda con la stessa lunghezza d’onda, con ampiezza doppia ed ancora in fase con le prime due:

due onde, con la stessa lunghezza d’onda, in controfase si sottraggono, originando come risultato un’onda nulla:
due onde invece che siano semplicemente sfasate si sommano e si sottraggono a seconda della sfasatura punto per punto in un modo abbastanza complesso che non ci interessa analizzare, al di là della figura riportata:

possiamo anche far vedere le tre situazioni con le onde componenti e quella risultante, sovrapposte:
Questi erano i concetti che interessava introdurre, per capire le idee geniali di De Broglie e di Schrödinger.
Onde o particelle?
Ci sono delle differenze ovvie tra particelle ed onde, almeno ad una prima visione superficiale. Una particella è localizzata esattamente in qualche luogo; un’onda è distribuita in una regione di spazio senza confini definiti.
Una particella ha una massa e delle dimensioni precise; un’onda è priva di massa e non ha delle dimensioni ben definite. Inoltre le quantità che abbiamo usato per definire le onde (lunghezza d’onda, ampiezza, frequenza) sembrano non avere alcun significato per le particelle.
Nonostante ciò De Broglie con una brillante intuizione fuse le idee di onda e di particella. Prima di descrivere il funzionamento della Meccanica Ondulatoria vediamo di conciliare un poco le differenze tra onde e particelle.
Sia le onde che le particelle possono muoversi da un luogo ad un altro con una velocità ben determinata.
Sia le onde che le particelle possono trasportare energia da un punto ad un altro. Dati allora due punti A e B, possiamo trasferire impulsi, fornire energia, da A a B in due modi: con un’onda o con una palla (o altro oggetto materiale; in particolare: una particella).

Va detto comunque che l’onda non è una particella: le onde, in qualche modo, hanno delle caratteristiche corpuscolari ; le particelle, in qualche modo, hanno delle caratteristi che ondulatorie ed i due concetti sono strettamente connessi.
Nella Meccanica Ondulatoria di De Broglie e di Schrödinger si possono considerare le particelle come pezzetti di materia purché vengano associati a delle onde. L’onda è in qualche modo (come vedremo) legata alla probabilità che la particella si trovi in qualche punto dell’onda stessa.
Consideriamo allora un’onda con una determinata frequenza n e lunghezza d’onda l:

Quest’onda è diffusa in tutto lo spazio; a ciascun suo punto può quindi essere associata una particella: la probabilità di trovare la particella è la stessa in ciascun punto dell’onda, questa probabilità è costante e quindi la particella può trovarsi dovunque nello spazio occupato dall’onda.
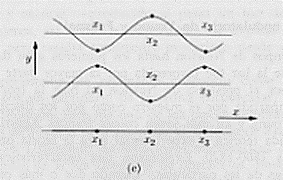
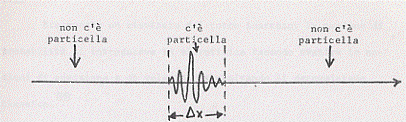
Consideriamo ora più onde di diverse frequenze che interferiscono fra di loro in modo tale che le loro ampiezze si elidano reciprocamente ovunque (operando in un modo analogo a quanto abbiamo visto per due onde sfasate tra di loro) all’infuori che in un ristretto spazio Dx. Questo insieme di onde possiamo chiamarlo “pacchetto d’onde”. Allora la particella che è associata a queste onde si troverà sicuramente all’interno “del pacchetto”.
Consideriamo un esempio relativo a quattro onde con quattro differenti valori della frequenza e della lunghezza d’onda

Queste onde, come si vede dalla figura, originano un pacchetto ben localizzato (l’onda, somma delle quattro, rappresentata tratteggiata nella figura precedente e riportata separatamente nella figura seguente):

dove c’è l’onda, cioè dove c’è il pacchetto, si trova la particella; dove l’onda è nulla non può esservi particella.
Considerando quindi un generico pacchetto si ha:
Così l’altezza (meglio: l’intensità) dell’onda in un punto è legata alla probabilità che la particella si trovi in quel punto e questa è una idea che ebbe Max Born e sulla quale torneremo con maggiori dettagli più oltre.
Dove l’onda è ampia (o forte) vi è una buona possibilità di trovare la particella. Dove l’onda è piccola (o debole) vi è una piccola probabilità di trovare la particella.
Come sono allora queste onde? Sono onde di probabilità. E questa è la prima grande idea della meccanica ondulatoria.
Era questo un risultato del tutto inatteso: la nozione di probabilità si introduceva in microfisica facendo svanire le nozioni di posizione e di velocità, e scalzando il determinismo classico.
La seconda, grande, idea della meccanica ondulatoria (De Broglie, 1924) fu lo stabilire una relazione tra la velocità v della particella e la lunghezza l della sua onda:
q = h/l
dove q = mv è l’impulso o la quantità di moto della particella (essendo m la sua massa e v la sua velocità), h la costante di Planck e l la lunghezza dell’onda associata al corpuscolo.
Si ha quindi:
mv = h/l => v = h /l m => v ~ 1/l
Ora il pregio fondamentale della relazione di De Broglie sta nel fatto che si legano fra di loro, ed anche in una relazione molto semplice, la quantità di moto q, che è una caratteristica corpuscolare, con la lunghezza d’onda l, che è naturalmente una proprietà ondulatoria. Le caratteristiche ondulatorie e corpuscolari di una particella sono legate insieme con una formula che ci dice che ogni e qualsiasi particella con quantità di moto q possiede un’onda associata di lunghezza d’onda l data dalla formula:
l = h/q
(la verifica sperimentale del comportamento ondulatorio degli elettroni e quindi della relazione di De Broglie, si ebbe nel 1927 ad opera di C. Davisson e L. Germer. I due fisici riuscirono ad ottenere la diffrazione degli elettroni, fenomeno tipicamente ondulatorio, servendosi delle tecniche di diffrazione dei raggi X introdotte da von Laue nel 1912 e dai Bragg, padre e figlio, negli anni successivi).
Una prima conseguenza di questa relazione è che le particelle “lente”, cioè con bassa velocità v hanno grandi lunghezze d’onda l e, viceversa, particelle “veloci” hanno piccole l:

Più in generale tutti gli oggetti materiali in moto hanno una natura ondulatoria e conseguentemente una lunghezza d’onda associata. Come esempio si può calcolare la lunghezza d’onda che compete ad un uomo che corre i 100 metri piani (m = 66 Kg; v = 10 m/s):
l = h/mv = (6,6.10-27)/(6,6.104.103) cm = 10-34 cm
se si ricorda che il diametro di un atomo è dell’ordine di grandezza di 10-8 cm e che le dimensioni di un nucleosono dell’ordine di 10-12 cm ci si rende subito conto dell’impossibilità, anche solo di pensare di poter sottoporre ad una qualche verifica sperimentale un tale dato.
Calcoliamoci ora la lunghezza d’onda associata ad un elettrone (m = 9.10-28 g; v = 108 cm/s):
l = h/mv = (6,6.10-27)/(9.10-28.108) cm = 7,3 . 10-8 cm
e ricordando anche qui le dimensioni atomiche, si vede subito che ora siamo a quell’ordine di grandezza che è anche quello delle distanze interatomiche. E’ possibile allora pensare di sottoporre a verifica sperimentale questo dato: si tratta di provocare l’interferenza degli elettroni utilizzando delle particolari fenditure, quelle che separano due atomi in un cristallo. E’ ciò che riuscirono a realizzare nel 1927 Davisson e Germer, come già accennato, confermando così la teoria di De Broglie (altre esperienze si possono realizzare a conferma ella relazione di De Broglie ed una di queste va sotto il nome di effetto Compton (1923) sul quale però non mi soffermerò).
L’atomo ondulatorio
Un elettrone è un particolare tipo di particella. Ora noi sappiamo che l’elettrone è una carica negativa mentre il nucleo di un atomo è carico positivamente. L’elettrone viene quindi attratto dal nucleo. Allora l’elettrone non potrà trovarsi dovunque, ma avrà una maggiore probabilità di trovarsi vicino al nucleo.
Questo elettrone non sarà più rappresentabile come un pezzetto di materia, ma conseguentemente alla sua natura ondulatoria, sarà rappresentato da onde che si sviluppano lungo determinate orbite intorno al nucleo. Suogni orbita ci sarà una particolare on da: la caratteristica fondamentale di questa onda è il fatto di essere
un’onda stazionaria; ed un elettrone che si trova in una onda stazionaria si dice che si trova in uno stato stazionario.
Ma cos’è un’onda stazionaria?
Cerchiamo, prima di definirla, di costruircela in casa. Leghiamo una robusta striscia di gomma, ben tesa, a due punti fissi. Facciamo poi oscillare, con un movimento della mano in un punto vicino ad un estremo fisso, la striscia. Variando progressivamente il movimento della mano fino ad ottenere la frequenza giusta riusciremo a costruirci un’onda stazionaria, un’onda cioè che non muta la sua configurazione e che non si propaga.
Disegniamo un’onda generica ad un certo istante (in blu) e ad un istante successivo (in rosso):
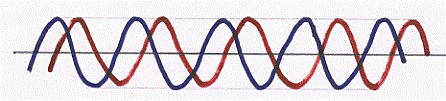
un’onda siffatta è un’onda che si propaga: non è quindi un’onda stazionaria.
Le onde che otteniamo invece con la nostra striscia, per diverse frequenze, sono fatte nel modo illustrato nella figura seguente:

Le linee in grassetto indicano la posizione della striscia nei punti di massimo spostamento; le aree ombreggiate indicano invece le regioni interessate al moto della corda. In pratica vi sono dei punti che si mantengono fissi e la striscia oscilla su e giù mantenendo fissi quei punti. Queste onde sono caratterizzate da nodi (i punti fissi nel disegno) e ventri (i punti a cui corrisponde il massimo spostamento della striscia dalla posizione di riposo) che non si muovono rimanendo sempre nelle medesime posizioni. L’evoluzione temporale di queste onde è data da uno spostamento trasversale massimo in un verso ed uno spostamento trasversale massimo nel verso opposto passando per la posizione di equilibrio. In ciascun punto della striscia si hanno quindi delle oscillazioni periodiche ma l’impressione che noi abbiamo guardando l’onda che abbiamo costruita è che niente si muova sulla striscia.
Sempre riferendoci alla nostra esperienza dobbiamo osservare che per mantenere l’onda è necessario continuare a fornire impulsi con la mano. Questo perché gli attriti (nei due punti a cui abbiamo fissato la striscia) e la resistenza dell’aria tendono a far smorzare le oscillazioni. Per questo le onde che creiamo in una vaschetta d’acqua o in una chitarra dopo un poco si annullano. Nel nostro mondo macroscopico, sulla Terra, con aria, attriti, gravità non esistono onde stazionarie se non le creiamo artificialmente fornendo in continuazione energia.
Ma nel mondo dell’infinitamente piccolo, nel mondo atomico, dove ovviamente non ci sono né attriti né
resistenza di aria, dove la gravità è trascurabile rispetto alle altre forze in gioco, allora potremo avere, anzi abbiamo, delle onde stazionarie. L’elettrone che si muove intorno ad un nucleo si muove “nella sua orbita” secondo un’onda stazionaria trovandosi quindi in uno stato stazionario.
Ad un’onda stazionaria compete una determinata energia che, fintantoché si mantiene la stazionarietà dell’onda, non viene dissipata.
L’elettrone quindi muovendosi intorno al nucleo secondo un’onda stazionaria non dissiperà energia, così come doveva accadere secondo la teoria classica di Lorentz, sotto forma di onde elettromagnetiche.
Si ritrova quindi una brillante spiegazione alla prima delle due ipotesi di Bohr: un elettrone su una determinata orbita non emette od assorbe energia.
Cerchiamo allora una spiegazione alla seconda ipotesi di Bohr: l’elettrone può muoversi solo su determinate orbite, essendogli impedite tutte le altre.
Ritorniamo alla nostra striscia di gomma e ricominciamo a farla oscillare. Le onde che riusciamo a creare sono soltanto quelle relative a determinate frequenze e non a tutte le possibili. Per quanti sforzi possiamo fare si avranno soltanto quelle onde che hanno un numero intero di ventri.
Supponiamo di aver creato un’onda stazionaria con tre ventri. Variamo di poco la frequenza facendo variare l’impulso che forniamo alla striscia con la nostra mano. Quello che otterremo è o un’onda con due ventri o una con quattro ventri, non ci sono vie di mezzo. Infatti una qualsiasi altra frequenza intermedia non farà altro che annullare qualsiasi onda sulla striscia.
Allora, poiché ogni onda stazionaria ha una sua determinata energia, nel passare da un’onda stazionaria ad un’altra, si passa da un’energia ed un’altra ma non con continuità. Si avranno così dei salti energetici: nel passare da un’onda stazionaria con, ad esempio, tre ventri ad una con quattro si acquista energia (cioè all’onda stazionaria con maggior numero di ventri compete maggiore energia), facendo il salto inverso si perde energia.
Cerchiamo allora la condizione di esistenza di un’onda stazionaria relativamente alla lunghezza della striscia di gomma che abbiamo usato per il nostro piccolo esperimento.
Supponiamo che la striscia sia lunga L e che l sia la lunghezza d’onda dello stato stazionario che stiamo considerando. Si avrà:
L = n l => l = L/n
essendo n un numero intero e positivo, cioè un’onda per esistere deve avere una lunghezza d’onda l sottomultiplo intero della lunghezza L della striscia.
Applichiamo queste considerazioni all’elettrone nell’atomo. Consideriamo un’orbita elettronica di raggio r.
La lunghezza di questa orbita sarà 2pr. La condizione per l’esistenza di un’onda stazionaria su questa orbita è:
2πr = nl => l = 2πr/n
e questa è la condizione, di importanza fondamentale, di De Broglie.
Si capisce quindi che soltanto le orbite che soddisfano alla condizione di De Broglie esisteranno.
Ed ecco ritrovata l’altra ipotesi di Bohr, anche da un punto di vista formale. Infatti, mettendo insieme le due relazioni di De Broglie
q = h/l ; l = 2πr/n
si ritrova la condizione di Bohr di quantizzazione del momento angolare
mvr = n h/2π
Dalla prima relazione di De Broglie si trova:
q = h/l => l = h/mv
Sostituendo questo risultato nella seconda relazione di De Broglie si ha:
h/mv = 2πr/n => mvr = n h/2π
che è la relazione di Bohr di quantizzazione del momento angolare.
Il fatto poi che le onde associate all’elettrone possano avere soltanto determinate lunghezze spiega come mai l’elettrone possa avere soltanto determinate energie: infatti, finché l’elettrone è confinato nella sua orbita, esso non è soggetto ad alcun acquisto o perdita di energia essendo tutta la sua energia una energia di movimento, di tipo, cioè, cinetico.
In base alla relazione di De Broglie ( l = h/mv) vista precedentemente, trovati i valori permessi per le lunghezze d’onda, si fa presto a trovare i valori permessi per le velocità e quindi per le energie.
La costruzione dell’atomo ondulatorio è allora fatta.

Questo modello venne immediatamente superato da tutto ciò che discese dai lavori di Schrödinger, il quale trattando matematicamente le onde di De Broglie nella sua ormai famosa “Equazione di Schrödinger” (che riporto per mera curiosità e per far vedere che la matematica cresce di difficoltà, passando alle equazioni differenziali alle derivate parziali):

trovò non più delle orbite intorno ad un nucleo, ma del le nuvole (che circondano a mò di buccia il nucleo) diprobabilità intorno al nucleo stesso. Ogni orbita elettronica si può considerare come una nuvola che circonda il
nucleo e le diverse orbite più interne (sulla forma di queste nubi di probabilità tornerò con qualche dettaglio più oltre.Cerchiamo ora di capire meglio ciò cominciando con l’introdurre il principio di indeterminazione.
Segue ….
Categorie:Atomi e Molecole
Rispondi