Roberto Renzetti
0 – PREMESSA
Perché nascesse la fisica del nucleo sarebbe stato necessario scoprire il nucleo. E perché si parlasse di nucleo occorreva capire che la materia ha una struttura atomica con un atomo avente una determinata struttura di cui il nucleo è parte. Insomma, poiché queste dispense non vogliono avere un carattere storico, ritengo sia comunque utile fissare alcune date importanti al fine di situare la nascita della fisica del nucleo atomico.
1896 – Il fisico francese Henri Becquerel scopre il fenomeno della radioattività da sali di uranio (scoperta assolutamente casuale. A Becquerel era stata regalata una “bella pietra” giallognola, un souvenir da un amico che aveva fatto un viaggio in Africa. Becquerel la ripose in un cassetto, sopra delle lastre fotografiche che conservava, ben protette dalla luce, per suoi esperimenti. Il mattino successivo Becquerel scoprì che quelle lastre erano impressionate e tutte riportavano il “disegno” della proiezione della pietra).
1897 – Il fisico britannico J. J. Thomson scopre l’elettrone e ne misura la carica e la massa. La presenza nella materia di una carica negativa fa supporre l’esistenza in essa di una carica positiva che però sfugge alla rivelazione.
1898 – I coniugi Pierre e Maria Curie (francese il primo e polacca la seconda) scoprono altri elementi radioattivi: torio, polonio, radio (da quest’ultimo, che fornisce la maggiore attività, prenderà il nome il fenomeno).
1899 – Il fisico britannico Ernst Rutherford scopre misteriose radiazioni, che chiama alfa (a) e beta (b), provenienti da materiali radioattivi.
1900 – Il fisico francese Paul Villard scopre altri raggi, provenienti da materiali radioattivi, che chiama gamma (g).
1906/1909 – Ernst Rutherford prova che i raggi a sono particelle cariche positivamente.
1909 – Ernst Rutherford ed i suoi collaboratori Geiger e Mardsen scoprono il nucleo dell’atomo e quindi il protone, la particella positiva che (fino al 1932) viene pensata come costituente principale del nucleo.
1910/1913 – J. J. Thomson e F. W. Aston scoprono l’isotopia, cioè quelle sostanze che hanno stesse proprietà chimiche pur presentando nuclei atomici diversi.
1911 – Rutherford elabora il suo modello atomico (si veda: Atomi e Molecole nel sito).
1913 – Il fisico danese Niels Bohr elabora il suo modello atomico che soppianta quello di Rutherford (si veda: Atomi e Molecole nel sito).
1932 – Il fisico britannico James Chadwick scopre l’esistenza del neutrone, una particella neutra che è costituente del nucleo. Diventa così chiaro il fenomeno dell’isotopia: è il numero dei protoni che qualifica chimicamente una sostanza; un elemento resta chimicamente lo stesso anche se varia il numero dei neutroni che costituiscono il suo nucleo.
A questo punto abbiamo in mano ciò che occorre per iniziare a parlare di fisica del nucleo. Un atomo, nel 1932, risulta costituito da un nucleo in cui vi sono protoni e neutroni intorno al quale ruotano degli elettroni:
– elettrone: particella di massa piccolissima e carica negativamente.
– protone: particella di massa circa 2000 volte quella dell’elettrone e carica positivamente.
– neutrone: particella con massa circa uguale a quella del protone e priva di carica (da cui il nome).

Figura 1

Figura 2
Io mi occuperò del solo nucleo dell’atomo in cui vi sono protoni e neutroni (per uno studio più dettagliato dei costituenti del nucleo atomico, si può vedere, nel sito, Una breve storia divulgativa delle particelle elementari) e nel quale, a seguito di reazioni nucleari complesse studiate come vedremo da Enrico Fermi, possono essere creati elettroni che vengono però immediatamente espulsi (raggio o radiazione b).
1 – PRIME DEFINIZIONI
In primissima istanza, il nucleo di un atomo è costituito da protoni, dotati di carica positiva e da neutroni, privi di carica. I protoni ed i neutroni costituenti il nucleo, sono genericamente chiamati nucleoni, senza ulteriori specificazioni.
Il numero dei neutroni in un nucleo è indicato con la lettera N; il numero dei protoni, detto numero atomico, con la lettera Z; infine il numero dei protoni più quello dei neutroni, il numero cioè dei nucleoni detto numero di massa, è indicato con la lettera A.
E’ facile vedere che in un nucleo vale la seguente relazione:
N = A – Z.
Con le notazioni introdotte, un qualsiasi elemento X della tavola periodica potrà essere indicato con il simbolo che gli compete (in questo caso, appunto, X) preceduto in basso e seguito in alto da due numeri, rispettivamente Z ed A:
ZXA.
Occorre osservare che, tra gli atomi di uno stesso elemento ve ne sono alcuni che hanno, nel nucleo, stesso numero di protoni ma differente numero di neutroni. A questi elementi, costituiti da atomi con diverso numero di neutroni nel nucleo, si dà il nome di isotopi.
Come esempio consideriamo l’atomo di idrogeno (H) che generalmente ha un elettrone orbitante intorno ad un nucleo costituito da un solo protone. L’idrogeno ha due isotopi chiamati deuterio e trizio i quali sono caratterizzati dal fatto di avere, rispettivamente, uno o due neutroni in più nel nucleo. In accordo con il simbolismo appena introdotto, il nostro idrogeno ed i suoi due isotopi saranno indicati nel modo seguente:
idrogeno 1H 1 ; deuterio 1H 2 (oppure 1D 2 ); trizio 1H 3 (oppure 1T 3 );
e, volendo rappresentarli, si avrà la figura 3 nella quale è anche riportato il carbonio ed i suoi isotopi.
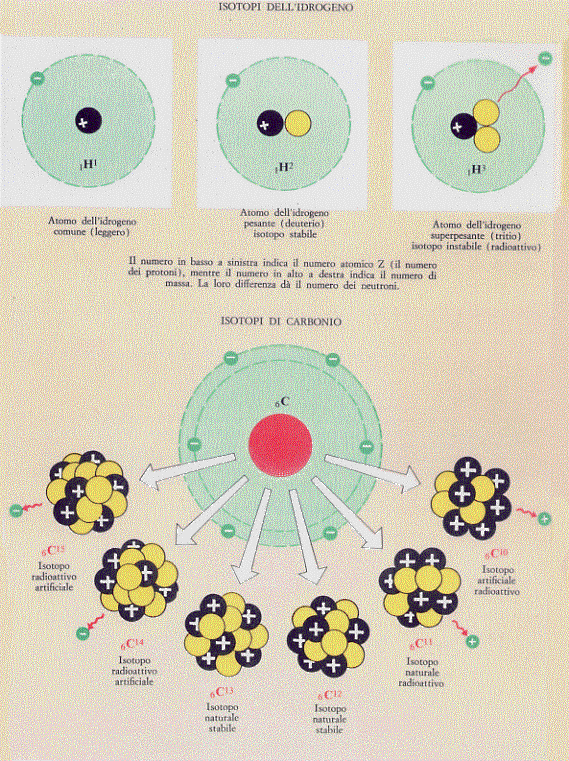
Figura 3
Occorre solo aggiungere che le proprietà chimiche di un elemento dipendono esclusivamente dal numero degli elettroni e quindi dei protoni dell’atomo. Di conseguenza, aumentare il numero dei neutroni di un nucleo, non cambia in alcun modo le proprietà chimiche del rispettivo atomo.
2 – DIMENSIONI DELLE MOLECOLE, DEGLI ATOMI, DEI NUCLEI . ALTRE DEFINIZIONI
Prima di procedere, conviene soffermarsi un poco sulle dimensioni con cui abbiamo a che fare nel mondo atomico e nucleare. Ci renderemo conto che stiamo trattando di oggetti infinitamente piccoli e scopriremo che la materia è ben diversa da quello che ci appare: in essa c’è una gran quantità di vuoto che supera di gran lunga il pieno.
L’atomo è il primo costituente un dato elemento (in natura ne esistono 92). Due o più atomi che entrino in combinazione chimica, costituiscono una molecola. Quest’ultima può essere costituita da due o più atomi dello stesso elemento (ed allora abbiamo ancora a che fare con l’elemento) o da atomi di due o più elementi diversi (ed allora abbioamo a che fare con un composto).
Per cercare ora di avvicinarci alla comprensione delle dimensioni delle molecole e degli atomi dovremo servirci di analogie e paradossi perché il dire che la molecola ha mediamente un diametro di qualche milionesimo di millimetro può dire poco.
Supponiamo di ingrandire l’intera nostra Terra di 10 milioni di volte in modo che una matita, lunga normalmente 10 cm, divenga grande come l’Italia; in questo fantastico mondo una molecola avrebbe il diametro di mezzo centimetro. Questa estreme piccolezza della molecola fa si che, all’interno dei corpi, ve ne sia un numero enorme. Prima di proseguire è conveniente introdurre il peso atomico ed altre utili grandezze, iniziando con il definire una unità di misura pratica (non appartenente cioè a nessun sistema di unità) che permette di non dover far ricorso ai piccolissimi numeri che fornirebbero i valori di massa per molecole, atomi e nucleoni. Si tratta dell’unità di massa atomica (uma), unità scelta arbitrariamente e corrispondente ad un dodicesimo della massa dell’atomo dell’isotopo 12 (quello con 12 nucleoni) del carbonio ( 6C12 ):
1 uma = 1,66.10-27 Kg.
Il peso atomico, relativo ad una unità di massa atomica, ci dice quante volte un atomo di un elemento pesa più di questa unità di massa. Dire, ad esempio, che il peso atomico del fluoro è 19 vuol dire che l’atomo di fluoro pesa 19 volte di più di un dodicesimo dell’atomo di carbonio 12 (oppure, che è lo stesso, ha una massa pari a 19 uma). Stabilito cos’è il peso atomico è facile definire il peso molecolare: la somma dei pesi atomici di tutti gli atomi costituenti la molecola. Sapendo, ad esempio, che l’ossigeno ha peso atomico 16 e l’idrogeno 1, si trova facilmente che il peso molecolare dell’acqua (H2O) è 1+1+16 = 18.
Vediamo ora cosa sono il grammo-atomo e la grammo-molecola: si definisce grammo-atomo di un elemento quella massa dell’elemento il cui numero di grammi è uguale al peso atomico dell’elemento (poiché, ad esempio, l’elio ha peso atomico 4, un grammo-atomo di elio equivale a quattro grammi di elio); si definisce grammo-molecola di una sostanza quella massa della data sostanza il cui numero di grammi è uguale al peso molecolare della sostanza stessa (per quanto già detto è facile riconoscere che una grammo-molecola d’acqua equivale a 18 grammi d’acqua).
Avendo a disposizione queste definizioni è possibile definire il numero di Avogadro (N): è quel numero di atomi, uguale per tutti gli elementi, contenuti in un grammo-atomo dell’elemento in considerazione o quel numero di molecole, uguale per tutte le sostanze, contenute in una grammo-molecola. Il valore calcolato per N risulta essere all’incirca:
N = 6.1023.
Se disponiamo, ad esempio, di una grammo molecola d’acqua, in essa vi sono 6.1023 molecole d’acqua. Quindi in un bicchiere, circa 200 grammi d’acqua, vi sono circa 1025 molecole. Quanto è grande questo numero? Prendiamo il nostro bicchiere e supponiamo si possano riconoscere le molecole d’acqua in esso contenute. Rovesciamo il bicchiere nel mare e supponiamo che le molecole d’acqua che vi si trovavano vadano a mescolarsi uniformemente con tutte le acque della Terra. Andiamo ora al rubinetto di casa nostra; prendiamo un bicchiere d’acqua; in esso troveremmo 2 000 molecole d’acqua appartenenti al bicchiere che avevamo versato nel mare. Se poi, invece di un bicchiere d’acqua, ne prendiamo la metà, gli atomi ( di idrogeno e di ossigeno) costituenti quell’acqua basterebbero per seminare l’intera superficie della Terra, nell’ipotesi di collocare un solo atomo per ogni centimetro quadrato. Si pensi poi che una sola goccia di pioggia contiene tanti atomi quante sono le gocce d’acqua contenute nel Mare Mediterraneo.
In definitiva molecole ed atomi sono entità estremamente piccole. Possiamo dire che il diametro medio di una molecola è dell’ordine di 10-9 metri, mentre quello di un atomo è dell’ordine di 10-10 metri; e ciò vuol dire che una molecola ha, come ordine di grandezza, un diametro dieci volte più grande di un atomo, ci vogliono cioè dieci milioni di atomi in fila per fare la lunghezza di un millimetro. Se dal diametro passiamo al volume, si scopre facilmente che il volume di una molecola è mille volte quello di un atomo. Quando passiamo ai costituenti dell’atomo le dimensioni diventano di gran lunga più piccole. E’ abbastanza noto che la massa del protone è circa 1800 volte quella dell’elettrone; questo dato, messo insieme al precedente che ci forniva il diametro medio di un atomo ed al fatto – che vedremo tra qualche riga – che il raggio di un nucleo è dell’ordine di grandezza di 10-15 metri, ci fa pensare che se ingrandissimo idealmente il nucleo fino a che assumesse la massa di una arancia, l’elettrone, con la massa di un pisello, si muoverebbe intorno ad esso in un’orbita con un raggio di una trentina di chilometri (come dire che, se mettessimo questa arancia in mezzo a Piazza Venezia a Roma, il pisello ruoterebbe passando sul litorale, su Tivoli, i Castelli, ….).
Insomma, stiamo parlando di entità infinitesime, infinitamente piccole e tali da sfuggire completamente ai nostri sensi ed anche ai più sofisticati microscopi (e ciò non per motivi tecnici ma per ragioni teoriche connesse con il Principio di indeterminazione di Heisenberg). Inoltre tutti i modelli meccanici che si possono pensare o, peggio, tutti i cambiamenti di scala immaginabili, non sono altro che piccolissimi stimoli intellettuali perché si comprenda che trattiamo di un mondo completamente differente da quello macroscopico che ci circonda. Nessun modello, per sofisticato che sia, che noi possiamo costruirci è, neppure lontanamente, corrispondente alla realtà. Il modello serve a noi per crearci una qualche immagine cui appenderci. Infine le leggi che regolano questo microcosmo sono il più delle volte diverse da quelle che regolano ilo macrocosmo, allo stesso modo che le regole che governano una famiglia sono diverse dalle leggi che regolano la società.
Per dare qualche numero più preciso cui riferirsi più oltre, possiamo dire che il nucleo ha un raggio R variabile (a seconda dell’atomo di cui è nucleo), in funzione del numero A di massa, tra i valori:
1,4.10-15 m ≤ R ≤ 8,7.10-15 m;
relazione, quest’ultima, che può anche essere scritta in modo più preciso facendo comparire esplicitamente in essa la dipendenza dal numero di massa A dell’atomo in considerazione:
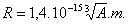
Il raggio, invece, di un nucleone è dell’ordine di grandezza di 10-16 m.
Se si confrontano questi ultimi numeri si scopre che l’atomo è nel suo insieme in massima parte vuoto (il rapporto tra raggio dell’elettrone e quello dell’atomo è circa lo stesso del rapporto tra raggio della Terra e della sua orbita intorno al Sole; inoltre – e qui propongo un’altra similitudine – : se si riuscisse ad eliminare tutto il vuoto esistente, ad esempio, negli atomi di 5 000 portaerei, si otterrebbe una palla da tennis con la massa però delle 5 000 portaerei!). Nel nucleo dell’atomo è concentrata la gran parte della massa dell’atomo (oltre il 99%) ma esso risulta 10 000 volte più piccolo dell’atomo. Tra questo nucleo ed i lontanissimi elettroni vi è un vuoto immenso.
Concludo questo paragrafo fornendo i valori di massa delle particelle fondamentali costituenti l’atomo:
– massa dell’elettrone Me = 0,9 . 10-31 Kg
– massa del protone Mp ≈ 1 836 Me
– massa del neutrone Mn ≈ 1 838 Me
e, dai numeri dati, risulta evidente che:
Mp = Mn .
3 – LE FORZE NUCLEARI
All’interno del nucleo, abbiamo già detto, vi sono protoni e neutroni; mentre questi ultimi sono privi di carica elettrica, i protoni sono dotati di carica positiva. Sappiamo però che cariche dello stesso segno si respingono con una forza data dalla legge di Coulomb:
Fc = ± (q1.q2)/R2
dove si ha segno + quando la forza è repulsiva (cariche dello stesso segno) e segno – quando la forza è attrattiva (cariche di segno opposto); K è una costante che ha dimensioni tali da rendere omogenea la relazione; q1 e q2 sono le due cariche elettriche poste tra loro ad una distanza r.
Proviamo a farci un conticino per vedere quanto dovrebbero valere le forze elettriche repulsive all’interno di un nucleo atomico.
Supponiamo che un nucleo atomico sia costituito da due protoni alla distanza di 10-15 m . Ricordando che la carica del protone (opposta a quella dell’elettrone) vale e = 1,6.10-19 coulomb ed applicando la legge di Coulomb, si trova che la forza repulsiva tra i due protoni vale:
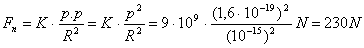
Per capire l’ordine di grandezza di questa forza, confrontiamola con quella attrattiva che tiene legato, ad esempio, un elettrone ad un protone in un atomo di idrogeno (ad una distanza r » 5.10-11 m):
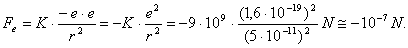
Facendo il rapporto tra Fn ed Fe , otteniamo:
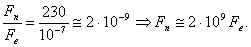
Risulta quindi che la forza Fn repulsiva tra i due protoni dovrebbe essere più intensa di circa 2 miliardi di volte quella Fe che tiene un elettrone legato in un atomo di idrogeno: i due protoni dovrebbero schizzare via come due proiettili supersonici!!!
La domanda è allora evidente: come fanno a coesistere in uno spazio così piccolo, il nucleo, due o più protoni ?
I fatti sperimentali mostrano che i nucleoni sono fortemente legati tra di loro nel nucleo, come è possibile ?
Pensiamo per un momento ad una analogia: supponiamo di tenere in ciascuna mano una striscia di nastro adesivo a penzoloni. Avviciniamo ora le mani per far aderire i due pezzi di nastro. Se nel moto di avvicinamento ci passa tra le mani una forte corrente d’aria proveniente da un ventilatore i due pezzi di nastro svolazzeranno da parti opposte praticamente respingendosi; quando però siamo arrivati a mettere in contatto le due strisce di nastro, allora nessuna corrente d’aria riuscirà a separarle. Nell’analogia la corrente d’aria rappresenta la repulsione elettrostatica che si esercita quando i due nastri (protoni) sono ad una certa distanza tra loro; quando poi i due nastri (protoni) sono a distanza ravvicinatissima essi sono tenuti insieme da una forza diversa da quella della corrente d’aria (elettrostatica) che prima li divideva: ora entra in gioco un’altra forza, quella di adesione (nucleare) che si fa sentire solo a piccolissima distanza.
Nel nucleo bisogna quindi considerare un tipo di forza, diversa da quelle elettromagnetiche e gravitazionali con le quali comunemente siamo in contatto, che è molto più intensa solo a piccolissime distanze (inferiori alle dimensioni di un protone o un neutrone) e si annulla rapidamente quando queste distanze diventano maggiori o uguali alle dimensioni di un singolo nucleone (intorno ai 10-16 metri): la forza nucleare. Quindi i protoni del nucleo sono certamente respinti tra loro dalle forze elettriche ma queste forze sono di gran lunga più piccole di quelle nucleari che invece li fanno attrarre (si noti che, all’aumentare della distanza, le forze nucleari, come già detto, non si fanno più sentire ed invece si fanno sentire le forze elettriche; per distanze che diventano molto grandi anche le forze elettriche svaniscono e si cominciano a far sentire le forze gravitazionali). Ma queste forze nucleari assolvono anche ad un altro ruolo: oltre a tener legati tra loro i protoni, tengono insieme anche neutroni con neutroni, protoni con neutroni e neutroni con protoni.
Dire però forze nucleari non vuol dire averne spiegata la natura. Per molti anni una grande quantità di fisici ha lavorato alla soluzione di questo problema arrivando, con il fisico giapponese Yukawa, nel 1935 ad una teoria secondo la quale nel nucleo, tra nucleone e nucleone, vi sarebbe una specie di colla nucleare costituita da tante particelle diverse da quelle fino ad ora incontrate. A tali particelle Yukawa dette il nome di mesoni p leggi pai) o pioni (si scoprì successivamente che di questi mesoni ne esistono di tre tipi: quelli con carica positiva, π+, quelli con carica negativa, π–, quelli neutri, π0. Inoltre si è trovato che la carica del mesone π+ è la stessa di quella del protone e che la carica del mesone π– è la stessa di quella dell’elettrone). Secondo la teoria di Yukawa, questa nuova particella, agente a livello di nucleo, doveva avere una massa circa 200 volte quella dell’elettrone. Il mesone verrebbe scambiato tra un protone ed un neutrone, tra un neutrone ed un protone, tra un neutrone ed un neutrone, tra un protone ed un protone, appartenenti al nucleo, senza appartenere né ad un protone, né ad un neutrone (forze di scambio). Vi sono immagini tratte dal mondo macroscopico che possono avvicinarci a quanto detto: innanzitutto si può pensare al fatto che due giocatori di tennis sono uniti da una palla che si scambiano e che non appartiene a nessuno dei due; si può poi pensare a due cani affamati (che in una situazione ordinaria si respingerebbero ringhiando) i quali restano fortemente legati tra loro mentre si disputano un saporito osso (questa immagine è del fisico russo Gamow). Ma è ore utile vedere in maggiore dettaglio come funzionano gli scambi di mesoni in un nucleo iniziando a considerare ciò che accade tra un protone ed un neutrone.
Un protone espelle violentemente da sé un π+ e nel far questo perde la sua carica e diventa un neutrone. Il neutrone che sta vicino all’originario protone assorbe invece il π+ convertendosi in protone. In accordo con questo modo di vedere, i neutroni ed i protoni in un nucleo si scambiano tra loro mesoni π+ e, nel far questo si trasformano gli uni negli altri. Un nucleone è quindi alternativamente un protone ed un neutrone. Analogo processo riguarda i π– . In questo caso il soggetto da cui partiamo è il neutrone: esso espelle un π– diventando conseguentemente un protone; il π– espulso viene catturato da un protone che diventa così un neutrone. I π0 vengono invece scambiati tra medesime particelle: essi agiscono tra protone e protone e tra neutrone e neutrone.
E’ importante osservare che il mesone, nel suo rapidissimo tempo di volo (10-34 s), non può esistere libero all’interno del nucleo. Si suole dire che esso ha un’esistenza virtuale o che è una particella virtuale. Riguardo poi alla massa di questa particella essa è stata calcolata a partire da un’importante considerazione fatta da Yukawa: il raggio d’azione di una forza deve essere inversamente proporzionale alla massa della particella che la trasmette. Anche qui una analogia ci può aiutare: si pensi a due giocatori di rugby; una palla leggera se la lanciano a distanza, ma se la palla fosse di cannone se la dovrebbero passare stando spalla a spalla.
Prima di chiudere questo paragrafo, è utile dire ancora qualcosa sul mesone e sul neutrone. Il mesone è una particella molto instabile (vedi più avanti) e ciò significa che essa, in un tempo molto breve (10-8 s), chiamato vita media, si disintegra o meglio decade in altre particelle o radiazioni (vedi più oltre). La stessa cosa vale per il neutrone o, almeno, vale fino ad un certo punto. Il neutrone è una particella stabile fintantoché si trova legato all’interno di un nucleo, salvo in alcune occasioni che vedremo nel paragrafo 7. Al di fuori del nucleo, invece, il neutrone (n) è instabile ed in un tempo di circa 11 minuti (vita media) decade annichilandosi. Da questa annichilazione nascono nuove particelle in una reazione nucleare (decadimento beta o interazione universale di Fermi o interazione debole) che fu capito nel 1933/1934 da Fermi e Pauli. I fatti sperimentali mostravano che alcuni nuclei emettevano radiazione β (leggi beta e vedi più oltre). Questa radiazione era essenzialmente costituita da elettroni. Altro mistero. Com’è possibile che vi siano elettroni in un nucleo? Le cose stanno così: un neutrone, per un processo cui accenneremo più oltre, decade all’interno di un nucleo. Ma il neutrone è neutro e, per la legge di conservazione della carica elettrica, carica nulla si deve anche trovare nei prodotti di decadimento. Ebbene, due particelle che insieme hanno carica nulla sono il protone p e l’elettrone e– . In termini di carica (e massa) le cose tornano. In termini di energia, impulso e spin: no. Se un neutrone decade in un protone ed un elettrone, sembra non valgano più le leggi di conservazione dell’energia, dell’impulso e dello spin. Fermi e Pauli si inventarono allora una nuova particella, il neutrino ν (leggi nu), che doveva far tornare i conti. Questa particella doveva essere priva di massa e di carica e dotata di energia (analogamente ai fotoni introdotti da Einstein ed ai raggi γ – leggi gamma – che vedremo più avanti), impulso e spin appropriati. Essa fu poi effettivamente scoperta sperimentalmente nel 1956. In definitiva, la reazione nucleare di decadimento di un neutrone è la seguente:
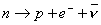
e si legge: un neutrone decade in un protone, un elettrone ed un (anti)neutrino che ha per simbolo quello del neutrino con una barra sopra (il fatto che invece del neutrino si avesse un antineutrino, fu scoperto in seguito).
4 – EQUIVALENZA MASSA-ENERGIA
La conservazione della massa è fatto ormai universalmente noto. Essa fu stabilita da Lavoisier verso la fine del Settecento. Allo stesso modo dovrebbe essere ben nota (anche se non capita) la conservazione dell’energia, ricavata da Helmholtz intorno alla metà dell’Ottocento. Per capire però che massa ed energia sono la stessa cosa occorre arrivare agli inizi del Novecento con i primi lavori di Einstein ed in particolare con quello che va sotto il titolo Sull’elettrodinamica dei corpi in movimento, generalmente indicato come il lavoro di Einstein sulla relatività ristretta. Non è il caso qui di andare a discutere questo fondamentale capitolo della fisica. Useremo solo una conclusione che venne qualche mese dopo la pubblicazione del primo lavoro citato di Einstein di relatività, L’inerzia di un corpo è dipendente dal suo contenuto di energia? Questo breve lavoro concludeva con una delle formule più popolari al mondo anche se non altrettanto conosciuta:
E = m.c2
Cerchiamo di avvicinarci alla sua comprensione. Innanzitutto E rappresenta l’energia, m la massa e c2 la velocità della luce elevata al quadrato. Leggendo l’intera formula nel suo insieme, essa dice che l’energia è data dal prodotto della massa per la velocità della luce elevata al quadrato. Poiché c2 è una costante (c2 = 9.1016 m2/s2), la relazione dice che l’energia e la massa sono, a meno di una costante moltiplicativa, la stessa cosa. Qual è allora la grande novità rispetto alla fisica classica ? La prima semplice osservazione riguarda proprio il fatto che c2 è una costante. Può sembrare banale ma qualcuno potrebbe osservare: l’energia totale E in dinamica classica è data dalla somma dell’energia potenziale e dell’energia cinetica; l’energia cinetica ha come sua espressione ½mv2 mentre l’energia potenziale (gravitazionale) è data da mgh; con facili conti si può ricavare che mgh può essere scritta come ½mv2 (basta ricordare che, nel nostro caso, risulta g = v2/2h e sostituire questo valore in mgh); cosi l’energia totale E risulta uguale a due volte ½mv2 e cioè E = mv2 ; qual è allora la grande novità di E = m.c2 ?
Nella relazione classica la massa e’ rigorosamente costante, per cui si ha:
E = k.v2
(graficamente, nel piano E,v, una ordinaria parabola).
Nella relazione relativistica invece c è rigorosamente costante, per cui risulta:
E = k.m
(graficamente, nel piano E,m, una retta con un enorme coefficiente angolare di modo che la retta quasi si confonde con l’asse delle ordinate).
Nel primo caso l’energia risulta proporzionale al quadrato della velocità, nel secondo l’energia risulta proporzionale alla massa e la costante k = c2 non è altro che un fattore di ragguaglio tra le unità di misura di massa e quelle di energia. Ciò vuol dire che l’energia e la massa relativistiche possono essere date con le stesse unità di misura potendosi parlare indifferentemente di grammi di energia o di joule di massa (un’energia pari a 9.1013 joule = 25.106 Kwh ha la massa di un grammo: si può allora dire la massa di 9.1013 joule oppure l’energia della massa di un grammo). Quanto detto ci può far intendere che parlare di conservazione dell’energia in relatività è la stessa cosa che parlare di conservazione della massa; e ciò può anche enunciarsi come conservazione della massa-energia. La cosa si può intendere come se un corpuscolo materiale non fosse altro che un granello di energia enormemente concentrata e localizzata; e, viceversa, l’energia pura la si può intendere come massa diffusa in un ampio spazio. Quella di Einstein è una sintesi stupenda che ingloba in sé perfino il primo principio della termodinamica: quell’energia termica che mancava all’energia meccanica, per far tornare la conservazione dell’energia meccanica, è tutta nella E = m.c2.
Dicevamo, qualche riga più su, che la massa relativistica è una grandezza variabile. La cosa è mostrata dalla teoria della relatività e non è qui il caso di soffermarcisi (chi volesse approfondire, può vedere, qui). Basti solo dire che le variazioni di massa (a cui si accompagnano variazioni di energia tali da mantenere fermo il principio di conservazione della massa-energia) sono legate alla velocità cui la data massa è portata. Cosicché ad un dato oggetto si associa una energia somma di due componenti: l’energia di massa, l’energia (cioè che il corpo ha per il solo fatto che esso esiste) e l’energia di movimento che già conosciamo (energia cinetica). In definitiva l’energia che spetta ad una particella immobile, o meglio a riposo, è proporzionale alla sua massa. Se poi essa è in moto ha un’energia in più, quella appunto di moto. Ma oltre a particelle dotate di sola energia di massa vi sono anche particelle dotate di sola energia di moto. Esse sono particelle prive di massa che possiedono energia per il solo fatto di muoversi (le particelle prive di massa viaggiano sempre alla velocità della luce). Tra queste le più note sono certamente il fotone ed il neutrino.
Purtroppo la prima pratica applicazione della relazione di Einstein l’abbiamo avuta su Hiroshima e Nagasaki. Lì si è dimostrato al mondo che una piccola massa ha un’enorme quantità di energia (si pensi che un solo protone che trasformasse tutta la sua massa in energia, ne avrebbe a sufficienza per riscaldare un miliardo di atomi a temperature più elevate di quelle esistenti sul Sole).
Per quel che ci servirà in seguito, conviene ora scrivere in forma leggermente diversa l’equazione di Einstein:
ΔE = c2 . Δm => Δm = ΔE/c2
avendo indicato con Δm la variazione di massa e con ΔE la corrispondente variazione di energia.
5 – ENERGIA DI LEGAME DEL NUCLEO
Nel paragrafo 2 abbiamo definito come unità di massa atomica la quantità:
1 uma = 1,66.10-27 Kg.
Esprimiamo ora in questa unità le masse dell’elettrone, del protone e del neutrone:
Me = 0,00055 uma
Mp = 1,00782 uma
Mn = 1,00866 uma
Le masse di queste particelle sono state calcolate quando esse non partecipavano ad alcun tipo di legame. Ora tralascio l’elettrone per concentrarmi sui nucleoni. Ci si aspetterebbe che con queste masse fosse possibile, sommando, trovare la massa del nucleo di qualunque atomo. Invece non è così. La cosa strana è che la massa di un nucleo (di un nucleo qualsiasi meno quello dell’idrogeno in cui vi è un solo protone e quindi non vi sono legami) non è mai uguale alla massa dei nucleoni che lo compongono. Prendiamo l’esempio del deuterio 1H 2 (o D) e calcoliamone la massa del nucleo come somma delle masse dei nucleoni costituenti quando sono tra loro separati e quindi diamo la stessa massa ma nella situazione di nucleo legato (così come lo conosciamo in natura). Si trova:
MD (non legato) = Mp + Mn = (1,00782 + 1,00866) uma = 2,01648 uma
MD (legato) = 2,01405 uma
Come si vede tra queste due masse vi è una differenza Dm data da:
Δm = MD (legato) – MD (non legato) = – 0,00238 uma = – 0, 396.10-29 Kg.
A questa differenza Δm si dà il nome di difetto di massa. Questo difetto è equivalente all’energia che viene liberata quando i nucleoni si combinano per formare il nucleo. Usiamo allora la formula di Einstein per vedere a quanta energia corrisponde questo difetto di massa (ci riferiamo ancora all’esempio del deuterio):
ΔE = c2 . Dm = 9.1016 . 0,396.10-29 J = 3,564.10-13 J.
Per lavorare meglio conviene introdurre una nuova unità di misura per l’energia (in luogo del joule J), l’elettronvolt (eV) l’energia cioè acquistata da un elettrone quando passa attraverso la differenza di potenziale di un volt:
1 eV = 1,6.10-19 J.
Conseguentemente un milione di eV (MeV) sarà dato da:
1 MeV = 1,6.10-13 J,
ed un joule varrà:
1 J = 0,625 MeV
cioè circa mezzo MeV.
Introducendo questa nuova unità di misura (cosa fatta solo per avere dei numeri più maneggevoli) nell’ultima relazione ricavata, si trova:
ΔE = c2 . Δm = 3,564.10-13 J = 2,22 MeV.
Se poi, invece di avere il difetto di massa corrispondente alla formazione di un nucleo di deuterio, abbiamo il difetto di massa pari ad una unità di massa atomica, mediante la solita relazione di Einstein, si vede subito che ad esso corrisponde una energia pari a:
ΔE = 931 Mev;
se, infine, il difetto di massa fosse pari ad un grammo, per DE avremmo:
ΔE = 5,6.1026 Mev !!!
Senza fare troppi conti (comunque banali) esiste una relazione generale che permette di calcolare il difetto di massa Dm per qualunque nucleo:
Δm = Z.Mp + N.Mn – Matomica
dove, ricordiamolo, Z è il numero atomico ed N il numero dei neutroni del nucleo in considerazione, Mp la massa del protone ed Mn quella del neutrone.
Ci si può a questo punto chiedere se le cose sperimentalmente, stanno così.
In laboratorio si può creare deuterio bombardando l’idrogeno con neutroni. Un modo per disporre di una sorgente di neutroni da utilizzarsi come proiettili da bombardamento fu ideato da Bothe e Becher (Germania) e Joliot e Curie (Francia) nel 1930. Il radio decade (si trasforma) spontaneamente in radon (un gas) emettendo radiazione alfa. Anche il radon decade spontaneamente emettendo radiazione alfa. Disponendo di una provetta contenente berillio e facendo penetrare in essa del gas radon (prodotto dal radio), la radiazione alfa, emessa dal radon, provoca l’emissione di neutroni da parte dei nuclei di berillio (in pratica si tratta di avvicinarsi a del radio – con ogni altra precauzione contro le radiazioni – con una provetta contenente berillio. Si inclina un poco la provetta verso il radio e si aspetta qualche secondo. A questo punto il berillio della provetta è diventato una sorgente di neutroni. Di questo metodo si servirono Fermi e la sua scuola per irradiare tutti gli elementi e, poiché la sorgente di neutroni si esauriva rapidamente, data la distanza del radio dal loro laboratorio, sono diventate leggendarie le loro corse per i corridoi di Via Panisperna). Bombardando allora idrogeno con neutroni, si ha la seguente reazione:
0n1 + 1H1 –> 1H2 + γ
che si legge: un neutrone che interagisce con un nucleo di idrogeno origina un atomo di deuterio ed un raggio γ (radiazione elettromagnetica ad alta energia – si veda oltre). Questa reazione emette dell’energia verso l’esterno (è esoenergetica): per formare cioè un atomo di deuterio da un neutrone e da un idrogeno si ha una certa quantità di energia che viene emessa verso l’esterno. Se si va poi a misurare l’energia che compete alla radiazione γ si trova che essa vale proprio 2,22 MeV. E questa è l’energia che corrisponde al difetto di massa che si origina nella creazione di un nucleo di deuterio (quando cioè nasce un nucleo di deuterio sparisce della massa e, a questa scomparsa, corrisponde dell’energia che viene creata ed emessa).
Vediamo, viceversa, cosa succede se, in laboratorio, bombardiamo il deuterio con radiazioni γ. Si ha:
γ + 1H2 –> 1H1 + 0n1
e cioè, quando un atomo di deuterio assorbe radiazioni γ , si può creare un atomo di idrogeno più un neutrone. Ed abbiamo detto si può perché se la radiazione γ ha energia inferiore ai 2,22 MeV la reazione non ha luogo. Solo se questa radiazione ha valori maggiori o uguali ai famosi 2,22 MeV il processo viene innescato. Questa reazione è, ovviamente, endoenergetica: l’energia non viene emessa a alla fine del processo ma, al contrario, viene assorbita al fine di produrre la reazione stessa. Siamo a questo punto arrivati a definire l’energia di legame di un nucleo: Nel caso del deuterio, l’energia di legame è l’energia che viene liberata quando un protone ed un neutrone si uniscono per formare il nucleo del deuterio medesimo (chiamato anche deutone), che, come visto, vale 2,22 MeV.
Generalizzando allora quanto detto per il deuterio, si può dire che l’energia di legame di un nucleo qualunque (meno l’idrogeno) è pari al suo difetto di massa. Essa può venire interpretata come l’energia che occorre cedere ad un nucleo per spezzarlo nelle sue particelle costituenti. E, in definitiva, per tutti i nuclei di tutti gli elementi (eccetto l’idrogeno) si ha che:
– per scindere un nucleo nei suoi componenti bisogna fornirgli l’energia di legame che gli compete (escludendo il caso, che vedremo nel prossimo paragrafo, di decadimento radioattivo naturale);
– per formare un nucleo a partire dai suoi componenti si libera l’energia di legame che gli compete.
Dovrebbe essere chiaro che si può anche parlare di energia media di legame per ogni singolo nucleone appartenente ad un ben determinato nucleo atomico (se l’energia di legame di un nucleo è 10 MeV ed i nucleoni che lo compongono sono 4, ogni nucleone avrà un’energia media di legame pari a 2,5 MeV). Questa energia media di legame per nucleone è la quantità di energia richiesta per strappare un neutrone o un protone da un nucleo (supponendo sia possibile disgregare un nucleo per estrazione successiva di tutti i suoi nucleoni!). Il grafico di figura mostra come variano le energie di legame per nucleone per differenti atomi dei vari elementi della tavola periodica, al variare del numero di massa A.
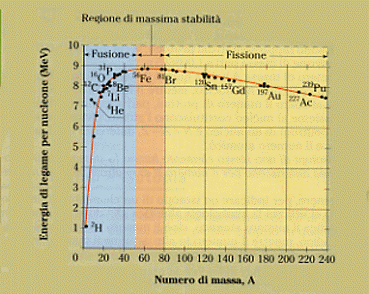
Figura 4
Dal grafico si vede che la curva cresce rapidamente per piccoli valori di A, raggiunge il massimo per valori di A compresi tra 50 e 90, quindi tende a decrescere debolmente (i valori dell’energia di legame per nucleone restano compresi tra 8,4 e 7,5 MeV), all’aumentare del peso atomico del corrispondente atomo. La parte destra della curva si riferisce agli elementi pesanti come, ad esempio, l’uranio; la parte sinistra si riferisce invece agli elementi più leggeri come, ad esempio, il deuterio H2.
Una considerazione interessante può venire ricavata da quanto detto sull’energia di legame. Ci si può infatti chiedere come mai le masse atomiche non sono precisamente multiple della massa atomica dell’idrogeno, pur essendo tutti i nuclei formati dalle stesse particelle: protoni e neutroni. E’ proprio l’energia necessari a legare un nucleo che fa sparire parte della massa, a volte a volte diversa a seconda del nucleo in considerazione, come mostrato in figura.
Un’altra notazione va fatta prima di chiudere il paragrafo: L’elio 4 ( 2He4 ), un isotopo dell’elio, pur avendo un piccolissimo valore di A (A = 4) si trova a pena alla sinistra del massimo di figura con un alto valore dell’energia media di legame per nucleone (confrontata con quella di altri elementi vicini). Questo fatto indica la grande stabilità dei nuclei di elio 4, fatto confermato dall’esperienza. Infatti nel fenomeno della radioattività (paragrafo seguente) vengono emessi dai nuclei atomici, dei loro pezzi che sono nuclei di elio 4 (2 neutroni e 2 protoni legati) e non altre possibili combinazioni di protoni e neutroni. Tali nuclei di elio 4, emessi da alcuni nuclei atomici, sono noti come radiazione α o particelle α (leggi alfa e vedi più oltre).
Da ultimo, diamo uno sguardo complessivo alla figura 4. Abbiamo già visto che c’è un massimo. In corrispondenza di esso si ha una maggiore energia media di legame per nucleone e ciò vuol dire che siamo nella situazione di nuclei più stabili, più fortemente legati. Ed allora è pensabile arrivare a questa zona di massima stabilità o costruendo dei nuclei più pesanti a partire da quelli più leggeri (strada che va al massimo da sinistra) o, viceversa, alleggerendo i nuclei più pesanti per farli diventare più leggeri (strada che va al massimo da destra). Il primo di questi processi va sotto il nome di fusione nucleare, il secondo di fissione nucleare; di essi ci occuperemo con qualche dettaglio nel seguito.
6 – ATOMI STABILI ED INSTABILI . RADIOATTIVITA’.
Da quanto detto nel paragrafo precedente risulta evidente che la stabilità di un nucleo (e quindi di un atomo) dipende dal valore della sua energia di legame. D’altra parte è già stato osservato, relativamente alla figura 4, che la zona più stabile è quella in cui il numero A di massa è compreso tra 50 e 90. Inoltre, quando si ha a che fare con atomi leggeri (piccolo valore di A), si osserva che lo stato più stabile si ha quando, nel nucleo, il numero dei neutroni è uguale a quello dei protoni (N = Z). Quando il numero di massa A aumenta, il nucleo assume delle dimensioni relativamente più grandi, tanto da far sì che i protoni localizzati in esso cominciano a sentire le forze repulsive di origine elettrica.
Da un certo valore di A in poi, quando il nucleo assume dimensioni molto grandi (atomi pesanti), le forze elettriche prevalgono su quelle nucleari ed allora questi nuclei cominciano ad essere formati da un maggior numero di neutroni che di protoni. In questo caso ci troviamo di fronte ad elementi che presentano il fenomeno della radioattività naturale.
Va subito detto che la maggior parte degli elementi esistenti in natura è stabile. Solo pochi hanno la proprietà di essere radioattivi. Gli elementi dotati di radioattività naturale sono quegli elementi che emettono spontaneamente dal loro nucleo delle particelle dotate di carica elettrica e non; essi hanno il numero atomico Z compreso tra 84 e 92 (serie dell’Uranio, del Torio e dell’Attinio) oppure sono isotopi instabili di alcuni elementi, molto stabili nella loro condizione normale, con Z < 84 (in natura se ne conoscono circa 25 di tali isotopi instabili).
Gli atomi di questi elementi instabili si trasformano, a seguito della perdita di particelle dal loro nucleo (decadimento spontaneo), in atomi diversi da quelli di partenza (trasmutazione nucleare). Molto spesso dall’ atomo di un elemento instabile si passa ancora ad un altro atomo di un altro elemento instabile e così via fino a quando non si giunge ad un tipo di atomo che è di un elemento stabile.
Vediamo un esempio di catena di decadimento a partire da uno degli svariati isotopi instabili (o radioattivi) dello Xeno, lo Xeno 140 e cioè: 54Xe140 . Dallo Xeno 140 si ha successivamente: Cesio (55Cs140), quindi Bario (56Ba140), poi Lantanio (57La140) ed infine Cerio (58Ce140) che risulta essere stabile. Ad ogni trasmutazione si accompagna l’emissione di radiazione β (si veda paragrafo seguente) di modo che lo schema del decadimento è quello di seguito riportato:
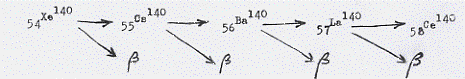
Le radiazioni nucleari sono dunque emesse dai nuclei atomici dei materiali radioattivi al momento della loro disintegrazione. La capacità di emissione non dipende da variabili macroscopiche come temperatura e pressione, presenza di campi elettrici e magnetici, eccetera.
E’ stato poi scoperto che oltre a questi elementi con Z compreso tra 84 e 92 ed agli isotopi naturalmente instabili o radioattivi, è possibile provocare artificialmente la radioattività bombardando gli atomi di certi elementi con neutroni. I nuclei degli elementi sottoposti a questo bombardamento catturano neutroni diventando degli isotopi diversi dall’elemento originale. Gli isotopi così ottenuti, a causa dei neutroni in più nei nuclei, si trovano con uno sbilanciamento tra numero di protoni e neutroni, risultano instabili e quindi radioattivi.
Concludendo occorre ricordare che in natura esistono elementi con Z fino a 92 (è il caso dell’Uranio che esiste in tre differenti isotopi tra i quali il più abbondante percentualmente è l’Uranio 238: 92U238). Gli elementi con Z > 92 sono e sono stati prodotti artificialmente, risultano instabili, quindi radioattivi e chiamati transuranici.
7 – RADIAZIONI ALFA (α), BETA (β) E GAMMA ( γ) .
La radioattività, sia essa naturale o artificiale, consiste nell’emissione da parte dei nuclei atomici di radiazioni alfa (α) e/o beta (β) e/o gamma (γ). Vi sono poi delle radiazioni neutroniche che vanno considerate a parte.
Le radiazioni alfa sono costituite da tanti nuclei di elio (o elioni), 2He4, scagliati dai nuclei della sostanza emittente. Ogni particella α è quindi costituita da due neutroni e da due protoni legati insieme (poiché un legame di questo tipo è, come abbiamo visto, molto stabile con energia di legame pari a 28,2 MeV). La carica di queste particelle è evidentemente positiva, il doppio, in valore assoluto, della carica dell’elettrone. Esse sono inoltre molto pesanti (hanno una massa pari a 4,04 uma) e conseguentemente, pur essendo scagliate a grande velocità dai nuclei (circa 20 000 Km/s), a causa della loro intensa reazione con le molecole d’aria, le ionizzano, perdendo gran parte della loro energia cinetica in tragitti che, in aria, vanno dai due agli otto centimetri. Nel caso poi queste particelle debbano attraversare materia solida, la loro perdita di energia avviene molto prima (sono bloccate da sottili foglie di carta o di alluminio, dai vestiti, dagli strati superiori della pelle). Si riassume tutto questo nel dire che la radiazione α è poco penetrante (Figura 5). Al contrario, se
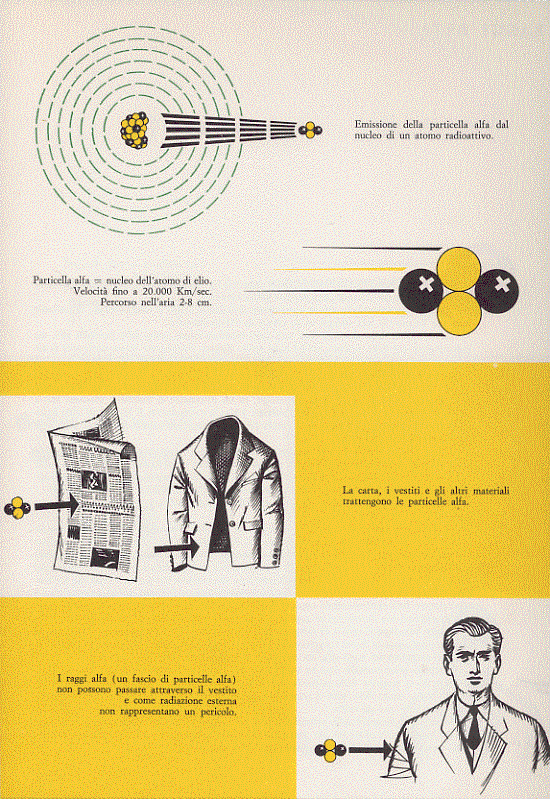
Figura 5
la sorgente è posta all’interno di un organismo vivente (per ingestione o inalazione di pulviscolo radioattivo), i danni che essa provoca sono enormi, veri disastri: in breve tempo i tessuti vicini alla sorgente sono distrutti da questi grandi proiettili dotati di una buona dose di energia. Attraversando la materia vivente le particelle a, dotate di carica positiva, interagiscono con gli atomi provocandone la ionizzazione; come risultato si ha la distruzione o il danneggiamento delle molecole del tessuto in considerazione.
Quando un nucleo emette una particella α il suo numero atomico Z diminuisce di due unità (dal nucleo se ne sono andati due protoni) mentre il numero di massa A diminuisce di quattro unità (dal nucleo, oltre ai due protoni, se ne sono andati anche due neutroni). Ad esempio, il nucleo del Radio 226 (88Ra226) decade, emettendo una particella α, in Radon 222 (86Rn222):
88Ra226 ————-> 86Rn222 +α .
La radiazione beta è costituita da fasci di elettroni di carica negativa o di elettroni di carica positiva (positroni, particelle che hanno stessa massa e stessa carica, cambiata di segno, dell’elettrone e che si indicano con e+) espulsi a gigantesche velocità (vicine a quelle della luce) dai nuclei atomici. Ci siamo già imbattuti nel paragrafo 3 nel rompicapo di elettroni espulsi da un nucleo. Ritorniamoci un momento con qualche dettaglio in più.
Il nucleo è formato da protoni e neutroni tenuti insieme dalla forze nucleari. I nuclei più stabili sono quelli che hanno un numero di neutroni pari a quello dei protoni. Ciò che accade è che, al crescere del numero di massa A, il numero dei neutroni N sopravanza, ed a volte anche di molto, il numero dei protoni Z. In questo caso si è in presenza di nuclei di atomi pesanti che, come abbiamo visto, da un certo punto in poi sono instabili. Supponiamo allora di avere un nucleo di Radio (88RA226), già considerato. In esso si hanno Z = 88 protoni ed N = 138 neutroni (in modo che N + Z = A = 226). Il rapporto tra neutroni e protoni in un nucleo di questo elemento è:
N/Z = 138/88 = 1,568.
Abbiamo già detto che il Radio 226 emette radiazioni alfa (e quindi perde dal suo nucleo due neutroni e due protoni) trasmutandosi in Radon 222. Nel nucleo di Radon si hanno allora 136 neutroni ed 86 protoni ed il rapporto tra essi vale ora:
N/Z = 136/86 = 1,581,
sono cioè aumentati percentualmente i neutroni rispetto ai protoni. Quindi l’emissione di radiazione alfa provoca l’effetto ora visto. Al crescere del numero delle emissioni alfa i neutroni aumenteranno sempre percentualmente rispetto ai protoni, finché si arriva ad un certo punto in cui i nucleoni rimasti nel nucleo devono arrangiarsi in modo da poter continuare a coesistere.
Ed allora, all’interno del nucleo si origina un processo che trasforma un neutrone in un protone ed un elettrone (oltre ad un neutrino). Il protone resta all’interno del nucleo andando ad aumentare la percentuale dei suoi simili; gli elettroni ed i neutrini vengono scagliati fuori. La reazione (decadimento beta) è quella che abbiamo già descritto nel paragrafo 3:
0n1 ———–> 1p1 + e– + ν
o meglio:
0n1 ———–> 1p1 + β– + ν
ed in definitiva dei nuclei emettono elettroni accompagnati da energia emessa sotto forma di neutrini. Vi è poi il caso, raro per la verità, di un nucleo che ha un eccesso di protoni. Analogamente a quanto visto, può essere il protone nel nucleo a diventare instabile ed a disintegrarsi emettendo il positrone cui abbiamo accennato ed il solito neutrino. Questa eventualità ha senso solo all’interno del nucleo infatti, al di fuori di esso, il protone è una delle particelle più stabili che si conoscano. Un esempio di decadimento beta positivo (β+) è quello che dal Tulio 69 porta all’Erbio 68:
69Tu166 ————–> 68Er166 + β+ + ν
(ed in questo caso si ha a che fare con un vero e proprio neutrino e non con un antineutrino, come nell’ordinario decadimento beta che ora vedremo).
L’elemento il cui nucleo abbia subito un decadimento beta aumenterà di una unità il numero atomico Z (a causa dell’acquisto di un protone da parte del nucleo) mentre manterrà invariato il suo numero di massa A (a causa del fatto che il protone acquistato va a bilanciare il neutrone perduto e del fatto che la massa dell’elettrone che è stato espulso è praticamente trascurabile). Vediamo alcuni esempi di decadimento beta (oltre quello già visto nel paragrafo precedente). Il Cobalto 60 (27Co60) mediante un decadimento beta diventa Nichel 60 (28Ni60):
27Co60 ———–> 28Ni60 + β– + ν .
Allo stesso modo, bombardando con neutroni l’Uranio 238 (92U238), si ha l’elemento transuranico Nettunio 239 (93Np239):
on1 + 92U238 ————> 93Np239 + β– + ν .
A sua volta il nettunio 239 decade, mediante emissione β, in Plutonio 239 (94Pu239):
93Np239 ———-> 94Pu239 + β– + ν .
Vediamo ora ad alcune caratteristiche delle radiazioni β. Le particelle β, innanzitutto, non hanno tutte la stessa energia come le particelle α . Essa può variare in un’ampia fascia di valori (da alcune centinaia di KeV ad alcuni MeV). Anche le particelle β ionizzano l’aria che attraversano ma in misura molto minore di quanto fanno le particelle α (spesso si ha a che fare anche con una ionizzazione secondaria: gli ioni prodotti dalla ionizzazione delle particelle β vanno a loro volta a ionizzare altri atomi). Proprio perché ionizzano meno (e quindi cedono una minore quantità di energia) le particelle β possono penetrare più a fondo nella materia. Nell’aria, ad esempio, possono percorrere (con una traiettoria a zig-zag, contrariamente alla traiettoria rettilinea seguita dalla particella α) tratti lunghi fino a 10 m; nella terra penetrano fino a 7 mm, nel calcestruzzo fino a 5 mm, nel piombo fino a circa 1 mm, mentre nella pelle possono penetrare per alcuni centimetri. In seguito a questo ultimo fatto le radiazioni β assorbite dall’uomo sono dannose per la pelle e, soprattutto, per gli occhi. Se l’assorbimento avviene invece all’interno dell’organismo, le lesioni che vengono provocate sono molto gravi.
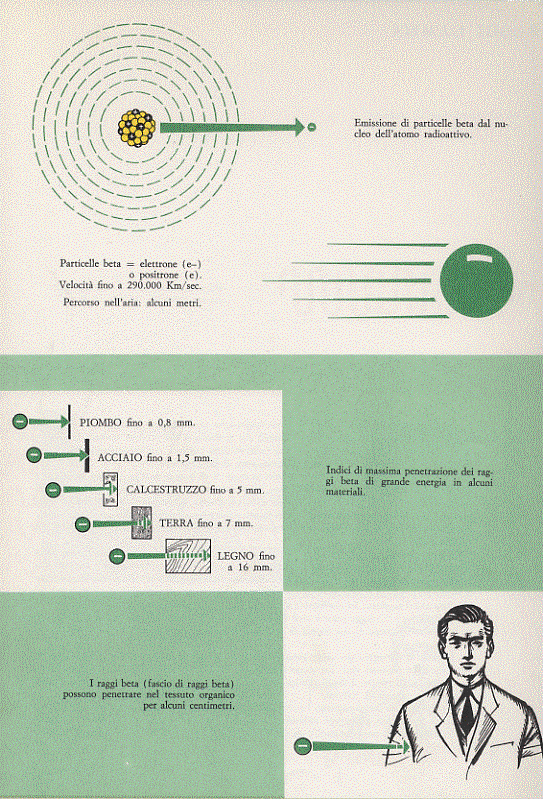
Figura 6
La radiazione gamma è, contrariamente alle altre due, esclusivamente energetica: non si tratta di particelle dotate di massa ma di particelle o quanti di sola energia (che varia da alcuni KeV a 2 MeV). Le radiazioni gamma sono fisicamente identiche ai raggi X di alta energia, l’unica differenza (oltre allo spettro di frequenza) è che i raggi gamma sono prodotti dall’interno del nucleo atomico mentre i raggi X in modo diverso. Si tratta di onde elettromagnetiche della stessa natura di quella della luce, ma con lunghezze d’onda molto più piccole (da 3.10-9 cm fino a valori di gran lunga più piccoli) e quindi con frequenze molto più elevate; queste radiazioni si propagano sotto forma di pacchetti (d’onda) di sola energia (fotoni) alla velocità della luce, sono prive di carica elettrica e, rispetto alle radiazioni alfa e beta, hanno un potere penetrante molto superiore e, conseguentemente, un potere ionizzante molto inferiore. Si pensi che la radiazione gamma penetra in media spessori di 14 cm di terra, di 10 cm di calcestruzzo, di circa 2 cm di piombo, oltre a riuscire ad attraversare completamente il corpo umano (mentre i raggi X sono bloccati dalle ossa, queste ultime sono trasparenti per i raggi γ . Quest’ultimo fatto rende conto dell’estrema pericolosità per l’uomo di questo tipo di radiazione.
I raggi γ accompagnano usualmente l’emissione di radiazione α e β e sono emessi da quasi tutti gli isotopi radioattivi artificiali e da alcuni elementi dotati di radioattività naturale. Il meccanismo di emissione di raggi γ da un nucleo è analogo all’emissione di fotoni da un atomo. Quando in un atomo un elettrone si trova in uno stato eccitato (orbita più elevata di quella che gli compete) tende a ritornare al suo stato non eccitato. Il salto di un elettrone da un’orbita più alta a d una più bassa comporta la perdita di energia da parte di un atomo; questa energia perduta viene emessa verso l’esterno sotto forma di fotoni o quanti. Analogamente per il nucleo: quando esso ha emesso radiazione α o β può trovarsi in uno stato anormale a cui compete una quantità di energia in più (stato eccitato). Il nucleo risulta eccitato e tende a perdere l’energia che ha in più emettendola sotto forma di radiazione γ o quanti γ o fotoni γ .
Vediamo una delle possibili reazioni cui si accompagna l’emissione di raggi γ . Se si bombarda con neutroni il Cobalto 59 (27Co59) si ottiene Cobalto 60 (27Co60) che si trova in uno stato eccitato; dopo poco tempo questo Cobalto 60 emette energia sotto forma di raggi γ raggiungendo il suo stato normale:
27Co59 + 0n1 ——–> (27Co60)* ——–> 27Co60 + γ,
dove il termine della reazione contrassegnato con asterisco sta a denotare lo stato eccitato del Cobalto 60.

Figura 7
Prima di chiudere il paragrafo occorre accennare alla radiazione neutronica, che non è propriamente l’emissione di neutroni da parte di un nucleo ma di neutroni che vengono liberati dai nuclei atomici durante i processi di fissione nucleare (vedi oltre); quando un nucleo pesante viene spezzato in due o più frammenti, alcuni neutroni appartenenti al nucleo iniziale vengono espulsi. Si tratta di una radiazione con una discreta massa e priva di carica. Proprio per questo ultimo motivo è estremamente pericolosa in quanto questi neutroni vengono facilmente catturati dai nuclei delle sostanze circostanti il luogo di loro produzione, alterando il rapporto di stabilità neutroni-protoni nei nuclei e rendendo quindi radioattive molte di quelle sostanze, tra cui aria, acqua, terra, … La radiazione neutronica è molto penetrante (ancora per l’assenza di carica, in quanto diminuiscono le interazioni di tipo elettrico con gli atomi e le molecole dei corpi attraversati), essa attraversa facilmente materiali che bloccano invece altri tipi di radiazione. I raggi neutronici, a parità di dose con i raggi gamma, sono da quattro a dieci volte biologicamente più efficaci.
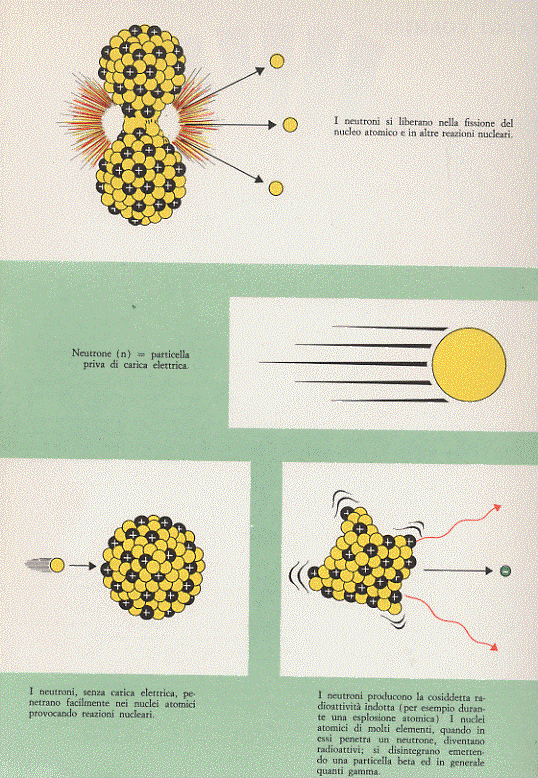
Figura 8
8 – TEMPO DI DIMEZZAMENTO. VITA MEDIA.
Il tempo di dimezzamento di un elemento radioattivo, che si indica in genere con T½ , è il tempo in cui la metà degli atomi radioattivi instabili inizialmente presenti, decade. Esso dipende evidentemente dal numero iniziale N0 di atomi dell’elemento radioattivo in considerazione.Supponiamo di avere un certo numero N0 di atomi di un elemento o isotopo radioattivo. Dopo un certo tempo (più o meno lungo, a seconda dell’elemento in considerazione) questi atomi decadranno. Ebbene, il tempo di dimezzamento, che è un valore caratteristico di ciascun elemento o isotopo radioattivo, è, come già detto, il tempo necessario a far sì che la metà del numero di atomi radioattivi inizialmente presenti decada. Passato questo tempo e decaduta la metà degli atomi radioattivi presenti, abbiamo ancora a che fare con un certo numero di atomi radioattivi, la metà dei quali, nello stesso tempo di dimezzamento, decadrà. In definitiva, dopo due tempi di dimezzamento, il numero di atomi radioattivi si è ridotto ad un quarto. Allo stesso modo, dopo tre tempi di dimezzamento, quel numero si riduce ad un ottavo, e così via.
La relazione matematica che descrive questo andamento è un esponenziale decrescente (curva di decadimento):
N = N0 . e-t/τ
dove N rappresenta il numero di atomi radioattivi presenti al tempo t, N0 il numero di atomi radioattivi inizialmente presenti, τ(leggi: tau) una costante caratteristica di ciascun elemento o isotopo radioattivo chiamata vita media. La curva che rappresenta la legge ora vista è riportata in figura 9.
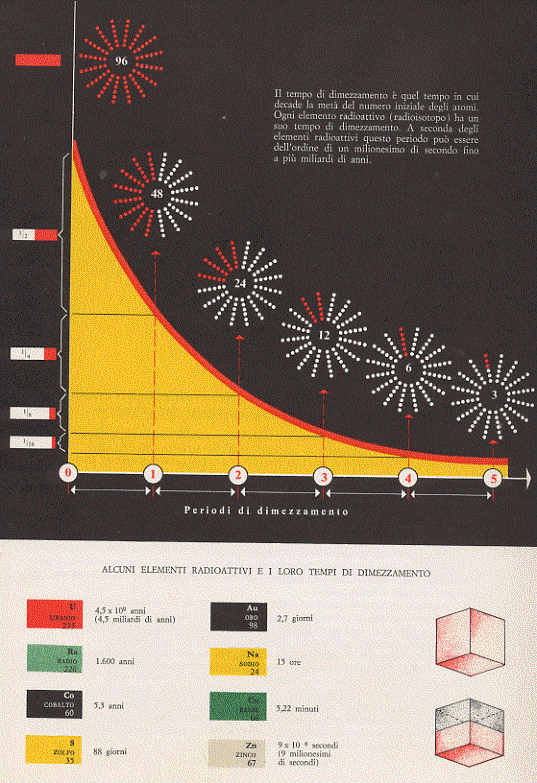
Figura 9
Essa ha la proprietà, ogni volta, di ridursi alla metà in un intervallo di tempo costante ed uguale a T½. Per i vari isotopi radioattivi il tempo di dimezzamento ha valori molto variabili. Ad esempio, per l’Uranio 238 esso vale 4,8 miliardi di anni; per il Radio 226 esso vale 1620 anni; per il Cobalto 60 esso vale 5,2 anni per lo Zolfo 35 esso vale 87 giorni; per l’Oro 198 esso vale 2,7 giorni; per il Rame 66 esso vale 4,34 minuti; per l’Indio 114 esso vale 72 secondi; per il Germanio 72 esso vale 300 miliardesimi di secondo. In definitiva il tempo di dimezzamento può variare dal miliardesimo di secondo a vari miliardi di anni.
Si definisce invece vita media di un dato elemento o isotopo radioattivo il tempo di esistenza che mediamente esso ha prima che decada (è il t che compare nella curva di decadimento, appena vista). Il concetto di vita media è strettamente correlato a quello di tempo di dimezzamento. Per comprenderlo riprendiamo un momento in esame l’ultima relazione scritta, la curva di decadimento. Abbiamo detto che il tempo di dimezzamento è il tempo T½ necessario a che un certo numero N0 di atomi radioattivi inizialmente presenti, si riduca alla metà, cioè a N0/2. Inseriamo allora queste condizioni ( N = N0/2 per t = T½) nella relazione in oggetto e vediamo cosa succede:

avendo semplificato per N0. Da questa relazione, passando al logaritmo dei due membri e operando un cambiamento di segno, si trova:
log 2 = T½ / τ —>T½= τ.log 2 —–> T½ = 0,693 . τ —> τ = T½ / log 2 —> τ = 1,44 . T½
E’ quindi solo un fattore numerico che differenzia la vita media dal tempo di dimezzamento (risultando la prima più grande del secondo).
Si deve osservare che tanto più piccolo è τ , tanto più instabile è un nucleo e quindi tanto maggiore è la sua attività in un dato tempo. Viceversa, a τ molto grandi, corrispondono elementi con poca attività. Al limite, gli elementi stabili sono quelli cui corrisponde un valore infinito di τ .
9 – LA FISSIONE NUCLEARE
La parola fissione deriva dal verbo fendere che vuol dire rompere. Provocare la fissione nucleare vuol dire provocare la rottura di nuclei atomici.. La reazione di fissione nucleare si realizza bombardando con neutroni, di appropriate energie cinetiche, i nuclei di elementi pesanti (i più instabili, i più facili da rompere). Questo bombardamento provoca la rottura dei nuclei in frammenti (due o più) più piccoli che sono, a loro volta, nuclei di elementi più leggeri (con diversi gradi di stabilità, a seconda delle percentuali relative di neutroni e protoni che rimangono in ciascun frammento). Il fatto comunque più interessante del processo di fissione nucleare è che, ad ogni rottura di un nucleo si accompagna l’emissione verso l’esterno di una grandissima quantità di energia. Ogni singola fissione libera una energia ΔE pari a:
ΔE = 3 . 10-11 J ≈ 200 MeV
Questa quantità è certamente piccola in assoluto ma si deve tenere conto che all’interno di 1 Kg di Uranio (per ora genericamente Uranio, senza precisare il tipo di isotopo) vi sono circa 2,5 . 1025 atomi. Se fosse possibile la completa fissione di tutti i nuclei di questi atomi (ma non lo è!), si avrebbe una energia pari a:
ΔE = 3 . 10-11 . 2,5 . 1024 J ≈ 7,5 . 1013 J ≈ 5 . 1026 MeV ≈ 23 milioni di Kwh (termici)
[L’aggettivo termici è stato introdotto per amore di precisione. Infatti, all’interno di una centrale nucleare, l’energia liberata da reazione nucleare va prima a scaldare acqua e quindi, dopo una o più trasformazioni, diventa energia elettrica. L’energia che noi abbiamo preso in considerazione è quella che scalda l’acqua. Per avere da questo valore l’energia elettrica occorre moltiplicare per il rendimento della trasformazione che è sempre un numero inferiore ad 1]. Poiché però una parte del materiale fissile a disposizione non produce energia poiché subisce solo delle trasformazioni senza essere fissionato, la quantità di energia fornita da 1 Kg di Uranio si riduce a:
ΔE = 19 milioni di Kwh (termici).
Si pensi che per produrre la stessa quantità di energia occorrerebbero circa 2 300 tonnellate di carbone o 1 650 tonnellate di nafta.
Il processo di fissione consiste quindi nel rompere un nucleo di un elemento pesante in due (o più) frammenti mediante bombardamento con neutroni. Va comunque detto che il bombardamento può avvenire anche con altre particelle o quanti (anche per fini pratici, si usano solo neutroni) e che i prodotti di fissione possono essere più di due (anche se ciò avviene con frequenze molto minori). Nella fissione i due frammenti principale prodotti (che sono poi, come abbiamo detto e vedremo ancora, nuclei di elementi leggeri) hanno un eccesso di neutroni e pertanto e pertanto risultano instabili. Essi, mediante successivi decadimenti, si trasformano in nuclei stabili. Oltre poi ai frammenti principali della fissione, vengono emessi anche neutroni (e questo è l’aspetto peculiare del fenomeno: questi neutroni, come vedremo, andranno a fissionare a loro volta altri nuclei) e radiazioni di vario tipo
L’elemento più usato nei processi di fissione è l’Uranio. Di questo elemento, in natura, esistono tre isotopi: l’Uranio 234 (92U234), l’Uranio 235 (92U235) e l’Uranio 238 (92U238). Tra questi isotopi solo l’Uranio 238 è presente in abbondanza (relativa), infatti ogni 100 000 atomi di Uranio, che si trova in natura, solo 6 sono di Uranio 234, 720 di Uranio 235 ed i rimanenti di Uranio 238. Trascurando l’Uranio 234, in natura si ha praticamente a che fare con Uranio 238 in cui vi è una piccola percentuale (0,7%) di Uranio 235. Ora, l’Uranio migliore per il processo di fissione è il 235 poiché è fissile, mentre l’uranio 238 è fertile. Un particolare elemento risulta fissile (può cioè dar luogo a fissione) se può essere fissionato da neutroni di qualunque energia, cioè sia da neutroni lenti che da neutroni veloci e particolarmente da questi ultimi dotati di velocità maggiori di 1,7.107 m/s. Si chiamano invece fertili quegli elementi che non sono fissili ma lo possono diventare a seguito della cattura, da parte dei loro nuclei, di neutroni. Vi sono poi altri elementi non fissili che possono essere fissionati solo da neutroni lenti mentre hanno la caratteristica di assorbire i neutroni veloci. Da quanto detto si può dedurre che i neutroni migliori per iniziare a sostenere un processo di fissione sono quelli lenti (il fenomeno fu scoperto da Fermi e collaboratori nel 1934). Intuitivamente la cosa si può capire nel modo seguente: un neutrone, in quanto privo di carica, si può muovere nella materia senza sentire interazioni di tipo coulombiano, nel far questo può urtare vari nuclei (ma si deve tener presente che non è l’urto in sé a rompere il nucleo); se l’energia cinetica di questo neutrone è elevata (neutrone veloce) esso può attraversare un nucleo senza produrre alcun effetto; viceversa un neutrone a bassa energia cinetica (lento o termico), nell’attraversare un nucleo, passando relativamente più tempo in esso, ha maggiore probabilità di essere catturato e di restare all’interno di esso (si usa dire che la sezione d’urto di svariate reazioni cresce enormemente al decrescere della velocità dei neutroni, la quale, si badi bene, non scende mai sotto i valori caratteristici dell’agitazione termica). Con il neutrone catturato al suo interno, il nucleo diventa instabile e si spezza in frammenti liberando energia.
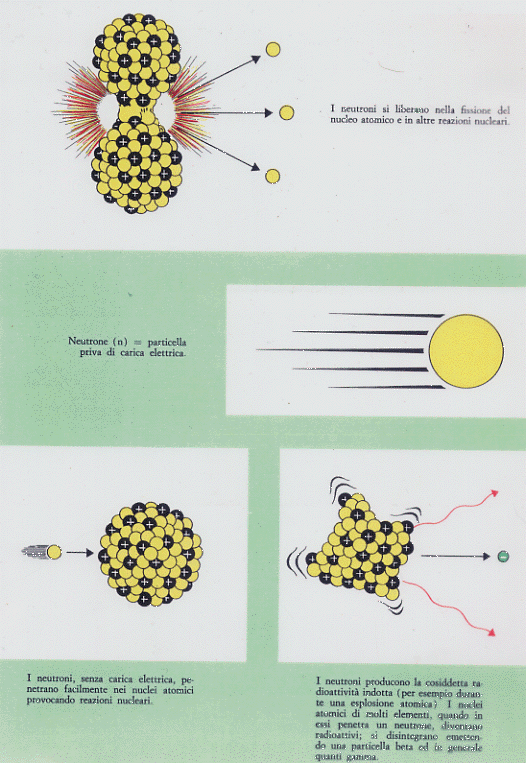
Figura 10
Esempi di materiali fissili sono: il già citato Uranio 235 ed il Plutonio 239 (94Pu239), elemento transuranico creato artificialmente in reazioni nucleari avente un tempo di dimezzamento di 24 000 anni (è importante osservare che
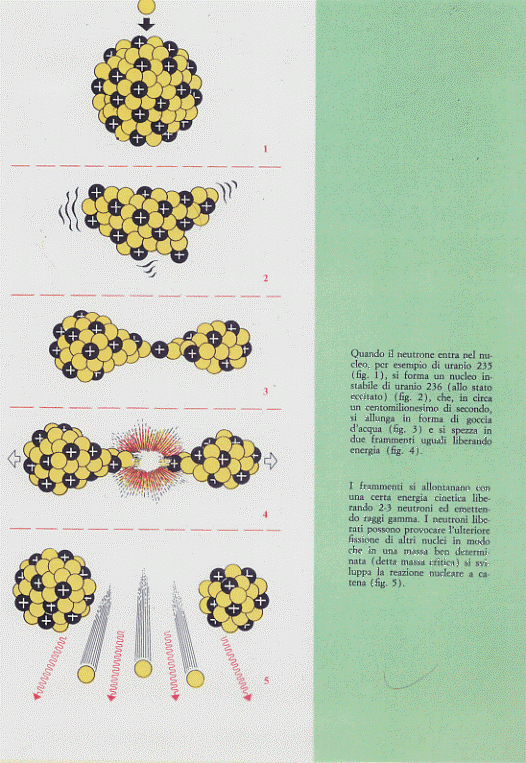
Figura 11
questi due elementi, oltre ad essere importanti perché fissili, lo sono anche perché, a ciascuna fissione, si accompagna l’emissione di 1, 2 o 3 nuovi neutroni che vanno a realizzare nuovi processi di fissione in un processo a catena che

Figura 12
discuteremo tra un poco). Esempi di materiali fertili sono: l’Uranio 238 ed il Torio 232. Infine esempio di materiale che può essere fissionato solo da neutroni lenti è ancora l’Uranio 238. Se ora si osserva che, data una prima fissione, tra i prodotti che vengono fuori da essa vi sono anche neutroni e che questi sono generalmente veloci, ci si rende conto che, provocata la prima fissione in nuclei di Uranio 238, essa non si può sostenere (questi neutroni liberati dalla rottura dei primi nuclei di Uranio 238, non sono buoni per rompere altri nuclei e tutto termina dopo le prime rotture provocate dall’esterno del materiale). Dopo le prime rotture, occorre procedere nell’operazione di rallentamento dei neutroni veloci in modo che, diventati lenti, vadano a fissionare altri atomi di Uranio 238. Il processo di rallentamento si realizza con particolari sostanze chiamate moderatori che devono avere alcune peculiari caratteristiche: essere costituite da nuclei di elementi leggeri (in questo caso un neutrone che urti uno di questi nuclei perde mediamente molta energia); essere una buona quantità (in modo che i neutroni non possano fuoriuscire da esse prima di essere stati rallentati); essere costituite da nuclei che non assorbano neutroni o ne assorbano il meno possibile (per non togliere un gran numero di proiettili ai nuovi processi di fissione). Nel caso dell’Uranio 238, che discutevamo, un ottimo moderatore è l’acqua pesante (D2O), acqua formata da molecole nelle quali l’idrogeno è sostituito dal suo isotopo Deuterio. Concettualmente si può procedere così (sarò maggiormente preciso più oltre) : vari pezzi di Uranio 238 (a geometria ed in quantità opportune) sono disposti in una vasca (a geometria opportuna) contenente acqua pesante; si attiva dall’esterno una qualche fissione nel primo Uranio a disposizione; da queste prime fissioni si liberano dei neutroni veloci; questi neutroni fuoriescono da quel pezzo di Uranio e fanno un determinato tragitto dentro l’acqua pesante e, nel far questo, diventano lenti; a questo punto incontrano di nuovo un altro pezzo di Uranio, dove provocano nuove fissioni e così via. Da quanto dicevo sembra chiaro che è di grande importanza, per il funzionamento della semplice macchina descritta, curare, come accennato, le quantità relative dei materiali in gioco e le geometrie di ogni componente dell’intero sistema.
Altra possibilità è quella di lavorare con Uranio 235. Altri sono però i problemi che qui si pongono. La percentuale di Uranio 235 in Uranio 238 è, come visto, molto piccola. I pochi nuclei di Uranio 235 presenti in un campione di Uranio naturale, non sono sufficienti a mantenere il processo di fissione. Quando provocassimo la fissione in un primo nucleo di un isotopo qualsiasi dell’Uranio presente in quel campione, i neutroni che ne verrebbero fuori (con probabilità enorme, neutroni veloci) non avrebbero il tempo di incontrare un altro nucleo di Uranio 235 prima di venire assorbiti dall’Uranio 238. In questo caso si procede con l’arricchimento della percentuale di Uranio 235 in Uranio 238, portandola da quello 0,7% al 4 o 5% (usi pacifici) in modo che, quando il processo di fissione è iniziato, i neutroni che vengono via via prodotti siano sempre in grado di incontrare un nucleo di Uranio 235 da fissionare. In questo caso si parla di Uranio arricchito (i processi di arricchimento dell’Uranio sono molto complessi, costosi e richiedono una tecnologia sofisticatissima. Tale tecnologia è anche soggetta a segreto militare.
La fissione di un determinato nucleo può avvenire in diversi modi e questo a causa del fatto che i neutroni ed i protoni del nucleo originario, quando avviene la fissione, si possono ripartire in modi diversi per formare nuclei più leggeri (prodotti di fissione), neutroni e radiazione. Come esempio consideriamo alcune delle reazioni nucleari che hanno luogo bombardando, con neutroni, nuclei di Uranio 235 (tenendo conto che le reazioni possibili sono oltre 40):
92U235 + 0n1 ——-> 38Sr94 + 54Xe140 + 2 0n1
92U235 + 0n1 ——-> 38Sr93 + 54Xe140 + 3 0n1
92U235 + 0n1 ——-> 32Kr92 + 56Ba141 + 3 0n1
92U235 + 0n1 ——-> 50Sn127 + 42Mo105 + 4 0n1
dove: Sr = Stronzio; Xe = Xeno; Kr = Kripton; Ba = Bario; Sn = Stagno; Mo = Molibdeno. Nella figura 13 è riportata una delle tante reazioni che riguardano l’Uranio 235, con i successivi decadimenti fino ad arrivare ad isotopi stabili.
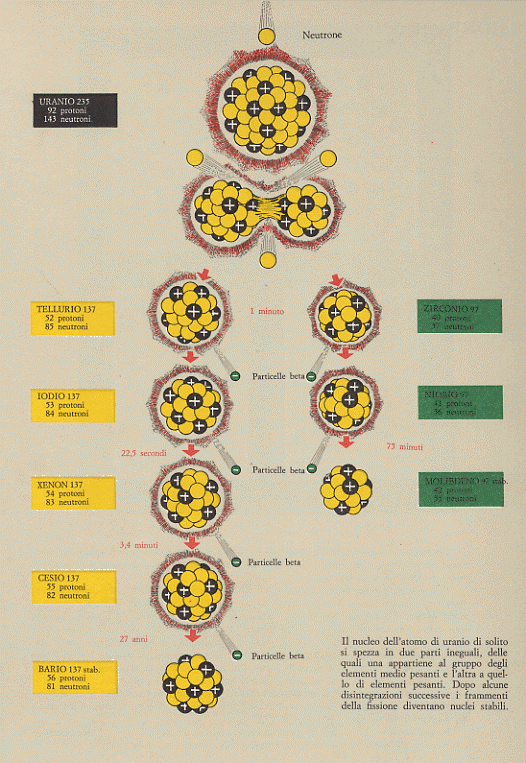
Figura 13
Quando allora un neutrone va a colpire un nucleo di Uranio 235 viene assorbito dal nucleo stesso il quale, in un tempo brevissimo (un centomilionesimo di secondo), si spacca originando due nuclei più leggeri, due o tre neutroni e radiazione. Questi neutroni escono dal nucleo fissionato con grande energia e vanno quindi a fissionare altri nuclei di Uranio 235 i quali, a loro volta, originano altri nuclei di isotopi più leggeri oltre ad altri neutroni che continuano il processo. L’intero processo si chiama reazione a catena ed è schematicamente illustrato in figura 14.
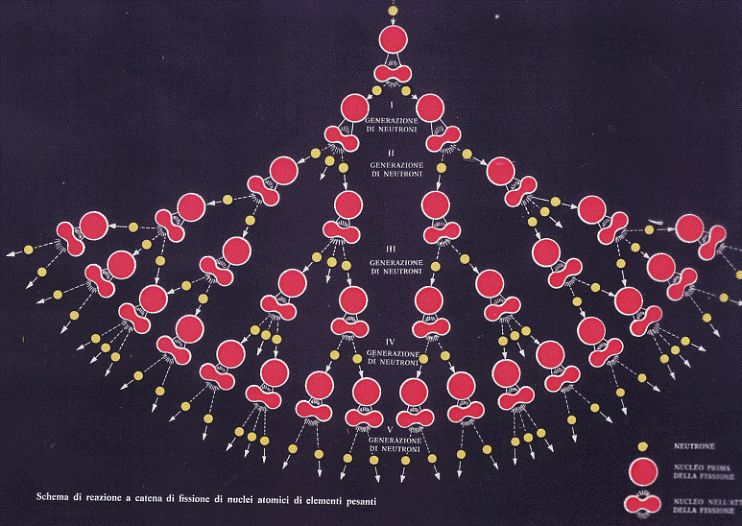
Figura 14
Reazioni a catena sono quei processi nucleari (e chimici) che una volta innescati si autosostengono interessando in brevissimo tempo tutta la massa del materiale a disposizione. Affinché la reazione si autosostenga occorre che la massa disponibile assuma un determinato valore (massa critica) per evitare che i neutroni sfuggano prima di aver
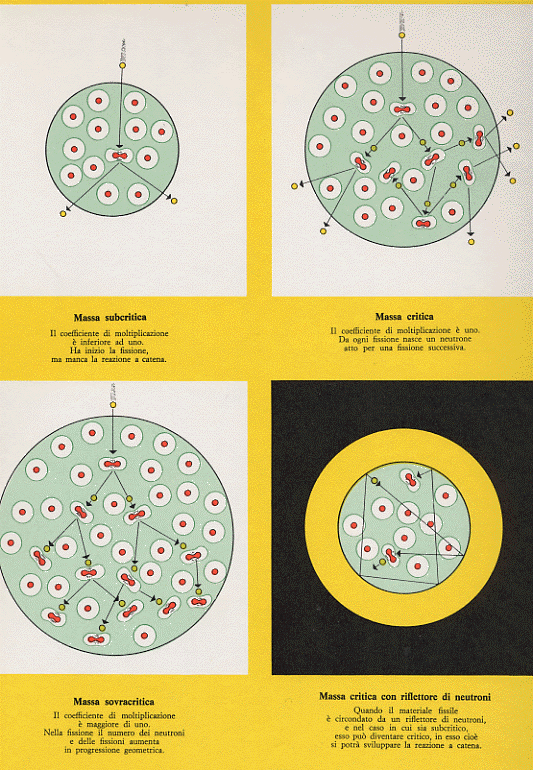
Figura 15
prodotto fissioni. Se infatti i neutroni prodotti dalla prima fissione non incontrano nel loro cammino altri nuclei da fissionare, la reazione a catena si blocca. Occorre allora che siano a disposizione tanti nuclei fissionabili in modo da sostenere la reazione a catena. La prima fissione avrà prodotto 2 o 3 neutroni che andranno a provocare mediamente un paio di fissioni (non tutti i neutroni provocano fissioni), nella seconda fissione avremo quattro neutroni, nella terza 8, quindi 16, 32, 64, 128, 256, … arrivati all’ottantesimo processo vi saranno disponibili 1024 neutroni. La probabilità di interessare sempre un maggior numero di nuclei alla fissione aumenta enormemente ed il processo si autosostiene. Un numero caratteristico di questi processi è il fattore di moltiplicazione che indica il rapporto tra il numero dei neutroni prodotti e quelli che hanno provocato la fissione da cui sono nati. Se il fattore di moltiplicazione è inferiore ad 1 (massa subcritica) non c’è reazione a catena; se il fattore di moltiplicazione è uguale o di poco maggiore ad 1 (massa critica) si ha la reazione a catena controllata per l’uso in centrali nucleari; se questo fattore risulta molto maggiore di 1 (massa sovracritica) si ha la fissione non controllata che è alla base delle esplosioni atomiche (in questo caso occorre intervenire con un maggiore arricchimento della percentuale dell’Uranio 235 in Uranio 238, dell’ordine del 7%).
Inoltre, se nella massa di materiale da sottoporre al processo di fissione, vi sono nuclei fissili (ad esempio di Uranio 235) mescolati a nuclei che assorbono neutroni (come è il caso dell’Uranio 238) e se la percentuale di nuclei non fissili è elevata, la reazione a catena non può sostenersi. Occorre quindi preparare i combustibili nucleari in modo si abbia una composizione critica tale da non far cessare la reazione (è quanto abbiamo già discusso a proposito dell’arricchimento dell’Uranio).
Infine poiché, come abbiamo già detto, i neutroni prodotti dalla fissione sono sempre veloci, essi hanno scarsa probabilità di andare a fissionare altri nuclei. Per aumentare questa probabilità occorre rallentare tali neutroni immergendo la massa di materiale da fissionare (precedentemente organizzata in modo geometricamente opportuno, come già accennato) in opportuni moderatori (sostanze di basso peso peso atomico) che hanno lo scopo di assorbire l’energia cinetica dei neutroni senza assorbire i neutroni stessi. I moderatori più in uso sono: l’acqua, l’acqua pesante, il berillio metallico, l’ossido di berillio, la grafite.
I reattori nucleari funzionano sfruttando i processi di fissione (alcuni dettagli li vedremo in una sezione apposita).
In alcuni reattori (LWR di tipo BWR o PWR: si legga “Reattori ad acqua leggera di tipo acqua bollente o acqua in pressione”) si usa come moderatore l’acqua mentre il combustibile è Uranio arricchito (e l’Uranio va arricchito perché l’acqua, oltre a moderare, assorbe anche dei neutroni). Abbiamo già visto quali sono i processi di fissione ce avvengono in questi reattori e che interessano l’Uranio 235. Vediamo ora cosa accade, parallelamente, all’Uranio 238 presente in gran quantità nel combustibile in uso. Quando un nucleo di Uranio 238 viene colpito da un neutrone si origina Uranio 239 che, essendo molto instabile, decade subito emettendo una radiazione β–, in Nettunio 239; anche quest’ultimo è un elemento molto instabile che, emettendo ancora una particella β–, decade in Plutonio 239. La reazione descritta è la seguente:
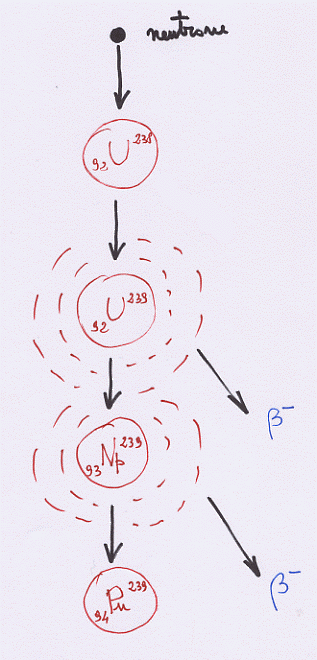
Figura 16
Si dovrebbe comprendere quindi che, come effetto secondario del funzionamento di un reattore nucleare LWR si abbia la produzione di una grande quantità di Plutonio, elemento estremamente pericoloso sia dal punto di vista chimico (è velenosissimo) che dal punto di vista fisico (dato che il suo tempo di dimezzamento è di 24 000 anni e che occorre attendere almeno 6 o 7 di questi tempi perché una sostanza radioattiva diventi praticamente inoffensiva, ci si rende conto che con il Plutonio occorre attendere un 160 000 anni per stare tranquilli: basta un poco di pazienza …).

Figura 17
In altri reattori (di tipo HWR o CANDU: si legga “Reattori ad acqua pesante o Reattori canadesi ad Uranio naturale moderati con acqua pesante”) si usa come moderatore l’acqua pesante mentre il combustibile è Uranio naturale. L’arricchimento in questo caso non è necessario in quanto l’acqua pesante ha la proprietà di assorbire molti meno neutroni (circa 600 volte meno) dell’acqua ordinaria; il maggior numero quindi di neutroni permette che la reazione si sostenga (andando a bilanciare il maggior numero di neutroni assorbiti dalla maggior percentuale di Uranio 238: sembrerebbe tutto più semplice ma i processi di fabbricazione dell’acqua pesante sono altrettanto complessi e sofisticati di quelli per arricchire l’Uranio, anche se qui viene meno, almeno direttamente, l’interesse militare).
Nei Reattori autofertilizzanti non si usano moderatori e quindi i neutroni non sono rallentati in modo da aumentare le frequenze delle fissioni. Per ottenere questo ultimo effetto in questi reattori si arricchisce l’Uranio naturale con atomi di materiale fissile come Plutonio 239 o Uranio 235. In questo modo i neutroni veloci sono in grado di mantenere la reazione. E, mentre essa va avanti nella parte centrale del reattore, intorno ad esso viene sistemato dell’uranio naturale i cui atomi di Uranio 238, assorbendo dei neutroni che sfuggono dalle reazioni che avvengono al centro, si trasformano in Plutonio (con la reazione vista nella figura 16) che sarà utilizzata successivamente come combustibile nella parte centrale del reattore (il Plutonio prodotto in questo modo è in quantità maggiore di quello che occorre per l’arricchimento del combustibile: per questo motivo i reattori così concepiti sono detti autofertilizzanti).
Altro elemento importante nel funzionamento di un reattore nucleare sono le barre di controllo che sono delle barre di materiali in grado di assorbire neutroni (cadmio, afnio, boro). Per regolare la potenza del reattore o per fermarlo si alzano o si abbassano queste barre sistemate tra gli elementi di combustibile, in modo da regolare la quantità di neutroni destinati alla fissione.
L’effetto finale utilizzabile di una reazione nucleare è la produzione di enormi quantità di energia che vengono asportate dal reattore prima sotto forma di calore e quindi sotto forma di energia meccanica immediatamente trasformata in elettrica. Per prelevare calore dalla reazione nucleare si utilizza un refrigerante (molto spesso è lo stesso moderatore che funge anche da refrigerante; è questo il caso dell’acqua. Nei reattori autofertilizzanti, data la maggiore quantità di calore prodotta, l’acqua ed altri sistemi ordinari non sono sufficienti, occorre utilizzare la circolazione forzata di sodio liquido) che andando a contatto con il combustibile si scalda fino a diventare vapore ad alte temperature e pressione, in grado cioè di mettere in moto le turbine.
10 – LA FUSIONE NUCLEARE
Accennerò appena a questo tipo di reazione nucleare: essa è ancora allo studio e non ancora in grado di fornire energia utilizzabile per scopi pacifici. L’unico uso pratico e realizzato dall’uomo di reazioni di fusione è quello della bomba all’idrogeno o bomba H. Viceversa, dalla fusione dipende la vita del nostro sistema solare e, in particolare, della Terra: sono reazioni di fusione nucleare che avvengono (a centinaia di migliaia) sul Sole che ci permettono fornendo l’energia necessaria al ciclo delle acque, alla fotosintesi ed a tutti i processi vitali.
Sulla Terra si sta studiando la possibilità di sfruttare questo tipo di energia.. Se si riuscisse a farlo avremmo risolto per secoli i problemi dell’approvvigionamento energetico (con quali ricadute sull’ambiente ancora non si sa molto bene; sembra comunque che gran parte dei pericoli connessi con i fenomeni radioattivi e le scorie di una centrale a fissione debbano scomparire).
La reazione di fusione consiste, come dice la parola, nel fondere insieme due nuclei leggeri per ottenerne uno più pesante. A questa reazione si accompagna l’emissione di una enorme quantità di energia (il rendimento è circa 6 volte quello che si ha con la fissione dell’Uranio. Ad esempio, fondendo 1 Kg di idrogeno in elio si liberano circa 180 milioni di Kwh di energia, mentre avevamo visto che con la fissione di 1 Kg di uranio si ottenevano 23 milioni di Kwh di energia) dovute al fatto che la massa del nucleo finale ottenuto è minore di quella dei costituenti iniziali e, come sappiamo, ad ogni perdita di massa corrisponde l’acquisto di enormi quantità di energia. Per innescare però una reazione di fusione vi sono problemi, in gran parte tecnici, considerevoli. Infatti, mentre il tramite delle reazioni di fissione era il neutrone (particella priva di carica), ora è necessario che i due nuclei che debbono fondersi vengano a contatto. Ma i nuclei sono dotati di carica positiva e quindi si respingono reciprocamente con una forza che, ricordiamolo, tende a diventare infinita mano a mano che la distanza tra le cariche dei nuclei tende ad annullarsi. Per riuscire ad avvicinare i due nuclei, vincendo la repulsione coulombiana, tanto che arrivino a fondere, occorre innalzare la temperatura a livelli impensabili (intorno ai 100 milioni di gradi kelvin, temperatura molto superiore a quella che c’è sulla superficie del Sole, solo circa 6000 °K) in modo che l’agitazione termica vinca la

Figura 18
repulsione di origine elettrica. Come ben si capisce i problemi, a questo punto, diventano tecnici: occorre studiare una pentola dentro cui sia possibile cucinare nuclei, ad esempio, di Deuterio (in modo che divengano nuclei di Elio) ed in grado

Figura 19
di resistere a temperature gigantesche. Svariate di queste pentole sono in studio nel mondo (Russia, USA, UE, Giappone, Italia). Non entrerò ora in qualche dettaglio di funzionamento (vedi la sezione relativa ai Reattori Nucleari) ma mostrerò alcune reazioni di fusione (con le relative energie liberate) ed in particolare quelle riguardanti gli isotopi dell’Idrogeno:
1H2 + 1H2 ——–> 1H3 + 1H1 + 4 MeV
1H2 + 1H2 ——–> 2He3 + 0n1 + 3,3 MeV
1H2 + 1H3 ——–> 2He4 + 0n1 + 17,6 MeV
1H2 + 2He3 ——–> 2He4 + 1H1 + 18,3 MeV
dove: 1H1 = Idrogeno; 1H2 = Deuterio; 1H3 = Trizio; 2He3 = Elio 3; 2He4 = Elio 4.
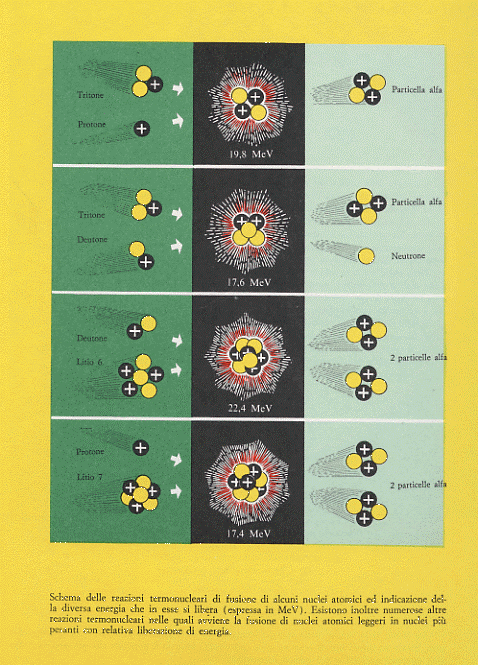
Figura 20
BIBLIOGRAFIA
1 – E. Segré – Nuclei e Particelle– Zanichelli, 1966.
2 – E. Persico – Gli atomi e la loro energia – Zanichelli, 1970.
3 – L. Eisenbud, E. P. Wigner – Nuclear Structure -Rinehart & Winston, 1963.
4 – M. Velimirovic – Atlante atomico – Capitol, 1970 (da questo testo ho tratto quasi tutte le figure da me riportate).
5 – L. Kervin – Atomic Physics – Holt, Rinehart & Winston, 1963.
6 – P. Fleury, J. P. Mathieu – Atomi, Molecole, Nuclei – Zanichelli, 1965.
7 – S. Tolansky – Introduzione alla fisica atomica – Boringhieri, 1966.
8 – W. R. Fuchs – Knaurs buch der módernen physik – Droemersche Verlagsanstalt, 1965.
9 – E. N. Jenkins – Radioactivity – Wikeham Publ. Ltd, 1979.
10 – G. Gamow – Biografia della fisica – EST Mondadori, 1963.
11 – E. Amaldi – Fisica generale – MARVES, 1965.
12 – R. Paoletti – Gli isotopi radioattivi – Hoepli, 1959.
13 – A. Isaacs, V. Pitt – La fisica – Mondadori, 1973.
14 – M. J. Gaines – L’energia nucleare – Mondadori, 1970.
15 – Academia USA de Ciencias – Fisica nuclear – Salvat, 1987.
16 – R. Renzetti – L’energia – Savelli, 1979.
17 – A. Baroni – L’atomo in catene – Cappelli, 1961.
18 – P.P.C. (Unità 6) – Il nucleo – Zanichelli , 1977.
19 – A. I. Kitaigorodski – Fotones y núcleos – Editorial Mir Moscú, 1985.
20 – V. Grigóriev, G. Miákishev – Fuerzas en la naturaleza – Editorial Mir Moscú, 1985.
21 – J. B. Marion – La fisica e l’universo fisico – Zanichelli, 1976.
22 – D. J. Hughes – Fisica del neutrone – Einaudi, 1960.
Categorie:Senza categoria
Rispondi