Roberto Renzetti
II principio di conservazione dell’energia (o 1° principio della termodinamica) fu per la prima volta enunciato in forma completa e chiara dal fisico tedesco Helmholtz nel 1847.
Se solo si pensa che ci troviamo a ben 150 anni dalla formulazione della meccanica di Newton, ci si rende conto della grande difficoltà che il problema comportava. Alla meccanica newtoniana erano estranei i concetti di lavoro ed energia, concetti che invece diventeranno “tecnologicamente” molto importanti in connessione con la seconda rivoluzione industriale. L’introduzione nei processi produttivi di una grande quantità di ritrovati tecnici poneva interrogativi sempre più pressanti: si trattava di sottoporre a trattamento teorico i problemi che si ponevano, si trattava di capire per ottimizzare i rendimenti delle varie macchine. Non ci si poteva più accontentare di quanto sostenuto da Newton: ogni perdita di “movimento” che si ha nell’Universo viene reintegrata da Dio.
Sulla strada aperta dagli studi di suo padre (Lazare) sulle macchine idrauliche, Sadi Carnot, già nel 1824, aveva capito e dimostrato che una macchina termica, anche se funzionante in modo ideale, ha sempre un rendimento inferiore al 100% (per il funzionamento di una tale macchina, parte del calore deve necessariamente e letteralmente essere scaricato nell’ambiente esterno).
Alla base della non esatta comprensione del principio di conservazione dell’energia c’era proprio questo tipo di complicazione sorta in connessione agli studi sulle macchine a vapore. Questa difficoltà derivava dal fatto che vi è un qualche cosa di asimmetrico nella trasformazione dell’energia: mentre tutta l’energia meccanica può trasformarsi in calore senza alcun residuo, l’opposto non si verifica mai; così quando si fornisce del calore ad una macchina a vapore, solo una parte di questa energia può essere impiegata per far girare l’albero ed un residuo inevitabile deve essere scaricato sotto forma di calore perduto nel condensatore della macchina.
Vi era poi un altro problema: occorreva capire che il calore è movimento. La cosa era già stata intuita da Galileo ma soltanto con Rumford (1800) si cominciò a lavorare su questa ipotesi.
L’enunciazione del primo principio non aiutava comunque a capire l’asimmetria cui abbiamo accennato. A questa asimmetria, con opportuna sistemazione, si è dato il nome di secondo principio della termodinamica. Il primo enunciato di questo secondo principio è dei primi anni della seconda metà dell’Ottocento ed è dovuto a Clausius:
“È impossibile realizzare una trasformazione il cui unico risultato sia quello di far passare del calore da un corpo più freddo ad uno più caldo“
A questo enunciato ne sono seguiti vari altri, tutti equivalenti tra loro e tutti in completo accordo con quanto già trovato da Carnot.
Il fatto che il secondo principio ci dica che il calore passa dai corpi caldi a quelli freddi o che una macchina termica non funziona se non dispone di due sorgenti a diverse temperature, non ci aiuta a capire l’origine dell’asimmetria: semplicemente si prende atto di un dato dell’esperienza.
Fu ancora Clausius (con vari contributi di Maxwell, Boltzmann, Kelvin, …) che ricorrendo alla teoria cinetico molecolare e cioè al punto di vista microscopico riuscì ad aprire la strada ad una più completa comprensione del 2° principio. Nelle trasformazioni del calore in altre forme di energia egli ebbe cura di distinguere tra la frazione di calore che può apparire sotto forma di energia meccanica e quella che deve essere scartata come calore perso. La frazione di calore che si trasforma in energia meccanica la chiamò energia libera, mentre chiamò entropia la frazione di calore che non si trasforma e che pertanto risulta persa (rimanendo nel sistema a temperatura più bassa).
Capire cos’è entropia è capire il 2° principio (e non solo, come vedremo). Per far ciò occorre rifarsi al punto di vista microscopico andando a vedere cosa succede ai singoli atomi che costituiscono un dato sistema termodinamico quando si effettua una trasformazione di lavoro in calore e viceversa.
Consideriamo due esempi: l’energia meccanica di un proiettile che, andando quest’ultimo ad urtare su di una lastra d’acciaio, diventa calore e l’energia meccanica delle ruote di un treno che, quando vengono frenate, si riscaldano. Seguiamo con le figure 1 e 2 (fortemente esagerate) il comportamento degli atomi dei due sistemi prima che essi vadano ad urtare o frenare (quando hanno solo energia meccanica) e subito dopo l’urto o frenata (quando hanno solo energia termica). Risulta evidente che, fintantoché c’è energia di movimento, tutti gli atomi seguono ordinatamente quel movimento; quando il movimento cessa e si trasforma in calore, tutti gli atomi si muovono disordinatamente in tutte le direzioni (si noti che il fenomeno interessa anche la lastra d’acciaio e la rotaia e, più in generale, ogni volta che si produce un dato fenomeno naturale esso e’ sempre accompagnato dal riscaldamento di tutti gli oggetti interessati al fenomeno). Se ora pensassimo di scaldare e il proiettile schiacciato
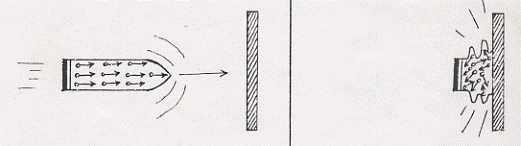
Figura1

Figura 2
e la ruota frenata, cosa vi aspettereste ? A questo punto non è più possibile pensare che il proiettile si rimetta in marcia all’indietro e neanche che la ruota si rimetta a camminare. Qual è l’effetto del riscaldamento, allora, degli oggetti di figura 1 e 2 ? Riscaldare significa fornire energia cinetica (movimento) ai singoli atomi e pertanto questi ultimi si muoveranno con maggiore velocità in tutte le direzioni e, se possibile, più disordinatamente.
Facciamo un esempio macroscopico per capire meglio questo aspetto. Supponiamo di avere una tazza con dentro un mucchietto di zucchero a destra ed un mucchietto di cacao a sinistra. Prendiamo un cucchiaino e giriamo cinquanta volte in verso orario dentro la tazza (avendo cura di muovere il cucchiaino piano piano e sempre radente al bordo della tazza). Che cosa abbiamo ottenuto ? Un miscuglio omogeneo di zucchero e cacao.
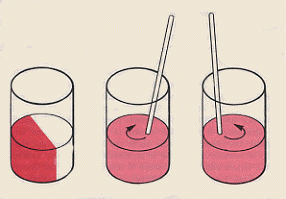
Figura 3
Prendiamo ora questo miscuglio ed operiamo su di esso in modo esattamente inverso: giriamo il cucchiaino cinquanta volte in verso antiorario dentro la tazza (avendo cura di muoverlo piano piano e sempre radente al bordo della tazza). Che cosa abbiamo ottenuto ? Se qualcuno si aspettava un mucchietto di zucchero a destra ed uno di cacao a sinistra si sbaglia: quello che abbiamo è, se possibile, un miscuglio ancora più omogeneo.
Quanto stiamo dicendo può essere semplicemente spiegato ricorrendo ai concetti di reversibilità ed irreversibilità.
Le trasformazioni che abbiamo preso in considerazione sono tipiche trasformazioni irreversibili ed i tentativi che noi facevamo per ricostruire la situazione precedente partivano dal presupposto, che esse, invece, fossero reversibili. Una trasformazione è reversibile quando essa si svolge in modo tale che, alla fine del processo, sia il sistema sia tutto ciò che ha avuto relazione con esso durante la trasformazione possono essere riportati alle condizioni iniziali, senza modificare nulla in tutto il resto dell’universo (una trasformazione è reversibile solo quando avviene lentissimamente e non è accompagnata da effetti dissipativi, quali attriti e cose del genere). Ci vuol poco a convincersi che in natura non esistono trasformazioni reversibili e cioè che la natura, ci offre solo trasformazioni irreversibili. Si può certamente lavorare in modo da avvicinarci sempre di più alla reversibilità, ma nella convinzione che una trasformazione reversibile non esiste.
Solo quella parte della fisica che va sotto il nome di “Meccanica” offre una quantità di situazioni reversibili, ma tutte frutto di notevoli astrazioni: ‘supponiamo che non vi sia attrito‘; ‘supponiamo di avere una massa, puntiforme‘; ‘supponiamo di avere una molla senza peso‘; ‘un filo inestensibile‘; ‘un urto perfettamente elastico‘; … Proprio per questo la meccanica offre una singolarità di grande importanza proprio in relazione alle considerazioni che stiamo facendo; le sue equazioni sono simmetriche rispetto al tempo. In esse si può sostituire, in luogo di t, il valore -t e tutto funziona regolarmente alla rovescia. Tutto è cioè reversibile. Infatti, per la determinazione dello stato di moto di un corpo rigido, la meccanica richiede solo che siano dati la sua posizione e la velocità del suo baricentro. Pertanto, da un punto di vista meccanico, avere 1’universo è avere un numero enorme di atomi con le loro posizioni e velocità. Elaborando matematicamente l’insiene di queste variabili si potrebbe, teoricamente conoscere dove evolve (e cioè qual è il futuro del1’universo e, cosa clamorosa, dal fatto che le equazioni della meccanica sono simmetriche rispetto al tempo, si potrebbe ricostruire tutto il passato dell’universo (e non solo materiale) fino alle origini. In fondo si tratterebbe solo di studiare una quantità di urti (!). E proprio queste considerazioni fece Laplace agli inizi dell’ 800 (quando la termodinamica ancora non esisteva). Egli infatti sostenne, nel suo “Saggio filosofico sulla probabilità” (1814):
“Dobbiamo dunque considerare lo stato presente dell’universo come l’effetto del suo stato anteriore e come la causa del suo stato futuro. Un’Intelligenza che, per un dato istante, conoscesse tutte le forze da cui è animata la natura e la situazione rispettiva degli esseri che la compongono … abbraccerebbe nella stessa formula i movimenti dei più grandi corpi dell’universo e dell’atomo più leggero; nulla sarebbe incerto per essa e l’avvenire, come il passato, sarebbe presente ai suoi occhi “.
Ma poiché questa Intelligenza non c’è, conclude Laplace, occorre far ricorso alla “probabilità” che ci permette di descrivere in modo più semplice il comportamento di una moltitudine di oggetti.
Tornando alla reversibilità (prima di vedere come anche noi dovremo far ricorso alla probabilità) certamente avrete visto più volte dei filmati proiettati a marcia indietro. Il film che illustra un fenomeno meccanico lo si può vedere in un verso od in senso inverso senza accorgersene o, comunque, senza che la cosa ci risulti strana o ridicola. In altri fenomeni, invece, e sono praticamente la totalità, vedere proiettato un filmato alla rovescia certamente ci lascerebbe interdetti o, quantomeno, ci farebbe ridere.
Se pensiamo all’urto di due palle da biliardo (o all’oscillazione di un pendolo) e quindi immaginiamo il fenomeno avvenire alla rovescia, tutto torna e la cosa ci funziona.
Pensiamo invece ad una bottiglia che cade da un tavolo. Essa va giù e, toccando il suolo si rompe in molti pezzi. Proviamo a vedere la scena alla rovescia. Niente da fare, non riusciamo a pensare a tanti pezzi di vetro che si rimettono insieme rifacendo una bottiglia (!); e che quindi la bottiglia ricostruita parta dal suolo, con grande slancio, per andarsi a posare delicatamente sul tavolo.
Mentre nel primo caso, ad un’osservazione superficiale o parziale, non è possibile stabilire un ordine tra gli avvenimenti, nel secondo caso c’è un ordine ben preciso: gli eventi si svolgono in un ordine determinato. E questo è valido per tutti i fenomeni naturali (se si pensa bene anche per le palle da biliardo o per un pendolo c’è un ordine di tempo: se guardiamo con attenzione tutto il film possiamo osservare che le palle prima hanno grandi velocità e poi sempre più piccole, finché tutto si ferma).
E’ interessante scoprire che le cose, in natura, vanno come il tempo: tutte in un verso.
Ma è possibile scoprire qual è questo verso ?
Supponiamo di avere due pentole d’acqua a temperature differenti. Mescoliamo l’acqua. La situazione finale è che il miscuglio d’acqua, spontaneamente, si porta ad una temperatura intermedia tra le due iniziali.
Supponiamo di avere un recipiente diviso in due settori, messi in comunicazione da un piccolo foro fornito di tappo. All’inizio del processo uno dei due settori sia pieno d’aria e nell’altro sia stato fatto il vuoto. Se togliamo il tappo l’aria spontaneamente diffonderà nel settore vuoto di modo che, alla fine del processo, essa sarà ugualmente distribuita nei due settori.
Supponiamo di avere un corpo caldo ed un corpo freddo. Mettendoli in contatto, per il sistema formato dai due corpi, troveremo una temperatura intermedia: spontaneamente del calore si è trasferito dal corpo a temperatura più alta a quello a temperatura più bassa.
A ben guardare, soprattutto quest’ultimo esempio, ci fa intendere che stiamo parlando del 2° principio della termodinamica.
C’è dunque una direziono verso cui gli avvenimenti tendono e, forse, proprio l’interpretazione microscopica del 2° principio può aiutarci a capire qual è questa direzione.
Un qualsiasi stato di un sistema è sempre caratterizzato dalla sua energia interna: i suoi atomi sono in moto a determinate velocità dipendenti solo dalla temperatura cui il sistema si trova. Abbiamo visto che i processi naturali comportano. alla fine, un riscaldamento di tutti gli oggetti appartenenti al sistema che subisce la trasformazione. Abbiamo anche detto che una situazione in cui si sviluppa calore comporta un disordine maggiore nel moto delle molecole. E poiché, in tutte le trasformazioni che avvengono in natura, in un modo o nell’altro, si sviluppa del calore, si può dire che: in tutte le trasformazioni naturali aumenta il disordine nel moto delle molecole del sistema che subisce la trasformazione.
Per capire meglio occorre dare un significato più preciso alla parola disordine. Nella figura 4 è riportato un contenitore diviso in due parti da un setto mobile. In ciascuna parte in cui è diviso il recipiente vi sono molecole di un gas diverso. Se togliamo il setto divisorio le molecole si saranno spontaneamente mescolate come in figura 5. Si può certamente dire che la configurazione di figura 4 è più ordinata di quella di figura 5.

Figura 4

Figura 5
D’altra parte, se pensiamo agli esempi fatti più su, anche il mescolare acqua calda e fredda comporta il passaggio da una situazione ordinata (acqua calda da una parte ed acqua fredda dall’altra) ad una disordinata (acqua mescolata); anche il mettere in comunicazione un contenitore pieno di gas con uno vuoto comporta il passaggio da una situazione ordinata ad una disordinata; anche la messa in contatto di un corpo caldo con uno freddo comporta la stessa cosa. A disordine si può dare il significato di stato più probabile.
Prima spieghiamo questa affermazione affidandoci al senso comune, passeremo poi a qualche definizione più precisa.
In casa vostra, nella camera dei bambini, dov’è più probabile trovare una penna, un giocattolo, una spilla. Se rispondete “al loro posto” vuol dire che non avete bambini. Lo stato più probabile è certamente il più disordinato. Ma non serve andare nella camera dei bambini, basta pensare ad una cucina o ad una qualunque stanza. Qualunque persona lavori in casa sa che il problema non sta nel mettere in disordine (fatto spontaneo), ma nel mettere in ordine (tant’e* vero che, a volte, si paga qualcuno per farlo).
Se prendete un mazzo di carte sistemato in un qualche cassetto di casa vostra (supposto che la casa sia ordinata !) qual è la probabilità di trovare tutte le ‘coppe‘ con le ‘coppe‘, le ‘denari‘ con le ‘denari‘, ecc., e di averle in fila (1,2,3,…) ? Credo si possa rispondere che ciò è quasi impossibile: le carte ‘preferiscono‘ sistemarsi nel modo più disordinato che è il più probabile. Ma – e qui arriviamo al nocciolo del problema – perché è più probabile che siano mescolate ? Perché il mescolamento lo si può ottenere in un numero enorme di modi (prima il 7 di bastoni, poi il 3 di spade, quindi il 5 di denari, …; oppure: prima il 2 di coppe, poi il 9 di spade, quindi l’asso di bastoni, …; oppure: …; oppure: …; …), mentre l’ordine lo si può ottenere in un solo modo (1,2,3,… di coppe; 1,2,3,… di denari; 1,2, 3,… di spade; 1,2,3,… di bastoni).
Per questo, lanciando una coppia di dadi, è più probabile che venga il 7; questo numero può essere ottenuto con un numero di combinazioni (l+6; 2+5; 3+4; 4+3; 5+2; 6+l) maggiore (6) di quello occorrente per qualunque altro numero (ed in particolare ottenere il 2 è tanto difficile quanto ottenere il 12; ambedue i numeri possono essere ottenuti in un solo modo). Sempre per lo stesso motivo, giocando la schedina, è più probabile fare l’otto od il nove che non lo zero (e, naturalmente, il 13).
Allo stesso modo per gli atomi che costituiscono un sistema.
Pensiamo ad un miscuglio di due gas in un recipiente; ci stupiremmo molto se, ad un dato istante, trovassimo tutte le molecole del gas 1 da una parte (magari offese) e quelle del gas 2 dall’altra. E se invece disponessimo di un solo gas in un recipiente diviso da un forellino in due zone A e B, ci parrebbe strano che questo gas si andasse a sistema re tutto in una zona (ad esempio la A). Si possono dare dei numeri relativi a quest’ultimo esempio.

Nella tabella è riportato: nella prima colonna, il numero di molecole costituenti il gas; nella seconda colonna, la probabilità dello stato con tutte le molecole in A, nella terza colonna, la probabilità che le molecole siano distribuite uniformemente in A e B. Come si vede, al crescere delle molecole costituenti il nostro sistema, cresce enormemente la probabilità di distribuzione uniforme (mentre quella non uniforme rimane costante). Se si pensa che le molecole costituenti un gas non sono 100, ma dell’ordine di 1023 (numero di Avogadro), ci si può, almeno lontanamente, rendere conto di quale numero, in questo caso, dovrebbe comparire nella terza colonna.
Pensiamo ora ad un altro esempio che ci fa intendere alcune delle cose dette a proposito delle figure 1 e 2.
Supponiamo che, ad un dato istante, gli atomi che costituiscono un sasso ‘decidessero‘, tutti, di dirigere le loro velocità in un verso determinato. Il fatto che tutti gli atomi dirigano le loro velocità in un solo verso comporta che la somma di queste singole velocità atomiche è un’unica velocità del sasso nello stesso verso di quello degli atomi. Se questo accadesse noi potremmo tranquillamente passare i pomeriggi, seduti su una panchina del parco a vedere saltellare i sassi. No, le cose non vanno cosi. Per orientare tutte le velocità degli atomi in un unico verso ci vuole un intervento esterno, ci vuole del lavoro fatto dall’esterno (si pensi che in un solo pezzettino di sasso vi sono 1023 atomi !!).
Su queste esemplificazioni si potrebbe proseguire all’infinito, ma ora ci fermiamo per ricapitolare un poco e, soprattutto, per cercare di rispondere a quella domanda, lasciata in sospeso, sulla ‘direzione dei processi naturali‘.
Abbiamo visto che: in natura si tende allo stato più probabile (quello che si può ottenere microscopicamente nel maggior numero di modi); lo stato più probabile è quello più disordinato. Se mettiamo insieme questi due risultati con gli altri che avevamo trovato, e secondo i quali in tutti i processi naturali parte dell’energia in gioco si trasforma in calore (2° principio della termodinamica) scopriamo che: in qualunque forma si abbia dell’energia, essa, in natura, tende a trasformarsi in calore poiché questa è una situazione cui compete maggiore disordine ed è quindi più probabile (quando dell’energia passa da altre forme a quella termica si usa dire che essa si è degradata). Quanto detto ci fa comprendere il perché l’irreversibilità presiede i processi naturali: una trasformazione di un sistema comporta sempre un grado maggiore di disordine degli atomi che lo costituiscono; la trasformazione inversa prevedrebbe il passaggio da uno stato disordinato ad uno più ordinato che, come sappiamo, è molto improbabile.
Il calore è quindi energia disordinata, mentre le altre forme di energia sono energie ordinate. In natura sono favoriti i passaggi più probabili quelli, cioè, da energie ordinate ad energie disordinate. Per questo tutto tende ad “andare in calore” ed è estremamente improbabile che del calore vada spontaneamente in energia meccanica.
Se cosi fosse sarebbe allora possibile che le molecole del mare si organizzassero in modo da trasformare la loro energia cinetica disordinata nell’energia meccanica ordinata che permetterebbe a tutte le navi di marciare gratis all’infinito (si osservi che l’energia che si può prelevare da1 mare è proprio quella delle situazioni più ordinate possibili: correnti, maree, differenze di temperatura tra strati superficiali e profondi, …).
Possiamo a questo punto trarre una prima conclusione: entropia è sinonimo di disordine (questo modo di vedere il problema fu introdotto da Helmholtz nel 1882). In natura hanno luogo i processi più probabili, quelli in cui si sviluppa calore, quelli in cui il disordine aumenta, quelli in cui l’entropia aumenta. In questo modo di vedere, i sistemi ordinati sono quelli a bassa entropia, mentre quelli disordinati sono quelli ad alta entropia: in natura si preferiscono le trasformazioni da bassa ad alta entropia, tutte quelle in cui l’entropia dello stato finale è maggiore di quella dello stato iniziale, tutte quelle in cui l’entropia aumenta. E proprio quest’ultimo è un altro modo di enunciare il 2° principio della termodinamica: in un sistema isolato possono aver luogo solo quei processi in cui l’entropia aumenta e poiché quelli sono i soli processi possibili, facendo un bilancio tra tutti i possibili processi che avvengono nell’universo, si può anche dire che l’entropia dell’universo aumenta.
Che implicazioni ha quest’ultima affermazione ? Dire che l’entropia dell’universo aumenta significa dire che il disordine dell’universo aumenta e, quindi, che tutti i processi che avvengono tendono a produrre calore il quale va, poco a poco, ad accumularsi in quell’immenso serbatoio che è l’universo. Quindi l’energia utilizzata e prodotta in qualunque parte di questo universo scarica in esso una parte di calore.
In questo universo l’energia non è distribuita in modo uniforme ma con dislivelli. Col passare dei secoli i dislivelli vanno appiattendosi di modo che via via diventa sempre più difficile produrre lavoro. Il principio di conservazione dell’energia (il 1° principio) ne esce salvo: poiché il calore è energia, il bilancio è tale che l’energia dell’universo si conserva. Ma, e qui sta il punto, il calore che via via va producendosi è a bassa temperatura, è energia disordinata che tende ad una stessa bassa temperatura (non si intenda con questo necessariamente temperature centigrade negative!). Quando fossimo giunti alla situazione in cui tutto l’universo fosse pieno di questa energia, ma tutta alla stessa temperatura, non potremmo più fare lavoro. Sono infatti le differenze di energia, di quota, di temperatura, di …, che ci permettono di ottenere lavoro. Quando la temperatura, anche se elevatissima, fosse tutte, livellata non ci sarebbe neanche più modo di misurarla: il mercurio del termometro si rifiuterebbe di fare lavoro spostandosi dalla posizione in cui si trova in una più in alto o più in basso e quindi neanche più quel lavoro si potrebbe ottenere. Si tratta della “morte calda” dell’universo e, a meno di nuove scoperte sul comportamento di quest’ultimo, a tutt’oggi ci avviamo verso quella morte (non vi preoccupate ci vogliono ancora miliardi di anni e, nel frattempo, il Sole si sarà spento o, più semplicemente, una banale guerra atomica avrà cancellato questo insignificante punto nello spazio chiamato Terra).
E’ proprio cosi, è un dato comune della nostra esperienza quotidiana. Mentre vediamo scorrere i fiumi verso il mare, mai abbiamo notato un ruscello che sale verso la montagna (senza che si faccia un lavoro dall’esterno); mentre vediamo i sassi rotolare giù da un pendio, mai abbiamo visto quanto illustrato in figura 6; mentre vediamo auto che

Figura 6
nell’urto si sfasciano, mai abbiamo visto auto malandate che, nell’urto, si rimettono a posto; mentre vediamo una bottiglia cadere e rompersi in mille pezzi, mai abbiamo visto mille pezzi mettersi insieme, formare una bottiglia e andarsi a sistemare su una mensola; mentre sappiamo che le bombe distruggono, mai abbiamo visto quanto illustrato in figura 7. E questo perché in natura si tende a situazioni che rendono minima l’energia
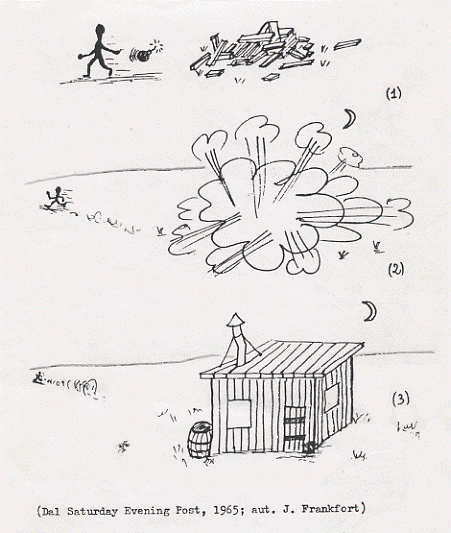
Figura 7
annullandone le differenze (altrimenti non si comprenderebbe perché un sasso cade sempre, un fiume scende sempre, un fuoco scalda sempre, del calore si produce sempre,…).
Ma, attenzione, la termodinamica è anche rispettosa degli stati d’animo: non scoraggia l’ottimismo. Infatti le leggi della termodinamica sono probabilistiche ed ognuna delle cose che prima abbiamo negato recisamente, in realtà la termodinamica non le esclude. Essa dice solo che certi fatti sono estremamente improbabili. Cosi se passando il tempo su quella panchina vedeste, un giorno, saltare un sasso, non preoccupatevi, è previsto! La termodinamica statistica ci permette anche di fare il conto della frequenza con cui può verificarsi un tale evento: uno ogni 1026 anni (!), basta un poco di pazienza ….
Il concetto di entropia, soprattutto con la sua spiegazione microscopica, è certamente importante; ma lo è di più se si vanno a cogliere alcuni suoi sottili significati.
Pensiamo al tempo: noi pensavamo che fosse l’unica grandezza che avesse un verso determinato ed ora scopriamo che questo verso è, nel tempo, di tutti i fenomeni naturali. E cosi, quando si parla di prima e dopo (fatto che ci definisce il passare del tempo) si può, allo stesso modo ed univocamente, parlare di bottiglia sana – bottiglia rotta.
Ma diciamo di più. Quando parliamo, per comunicare con qualcuno, ccrchiamo di farci capire (si pensi al problema che avevo di fronte nel momento in cui iniziavo a scrivere questo articolo) e ‘farci capire‘ significa organizzare le parole, i gesti, i toni, l’espressione nel modo più ordinato possibile. Più avremo realizzato una situazione ordinata, più saremo stati in grado di farci capire. E’ facile allora comprendere come informazione ed entropia siano strettamente correlate: più informazione c’è nel mio messaggio, minore è la sua entropia (in questo senso, se avete capito quanto ho fin qui scritto, vuol dire che l’entropia di questo lavoro è bassa, vuol dire che è stato necessario fare una grande quantità di lavoro dall’esterno il quale ha comportato all’esterno, e cioè nella famiglia, nella stanza dove lavoro, nel mio lavoro, un tale aumento di entropia, e quindi di disordine, che il bilancio tra l’eventuale bassa entropia di questo lavoro e l’entropia che ho creato per farlo è, per il 2° principio, a favore dell’aumento dell’entropia dell’universo). Si potrebbe forse capire in questo modo quanto i messaggi di certi organi di informazione e di certi politici siano ad alta entropia.
Ma non era solo per raccontare queste piccole cose che ho messo in relazione entropia ed informazione. Nella realtà questa correlazione è estremamente importante per comprendere la qualità, ad esempio, delle varie forme di energia nell’ipotesi che più bassa è 1’entropia di una fonte energetica, maggiore è il contenuto di informazione che essa porta con sé (più essa è pregiata).
Possiamo certamente dire che tra le varie forme di energia quella elettrica è la più pregiata mentre quella termica è la meno pregiata. Ma nell’ambito della stessa energia termica vi sono vari gradi di pregio, di qualità. Ad esempio, l’energia termica a più alta temperatura è molto più pregiata di quella a bassa temperatura proprio perché, a parità di calore scambiato, più alta è la temperatura più bassa è l’entropia. E quest’ultima cosa la si può vedere facilmente dalla definizione macroscopica di entropia:
S = ENTROPIA = CALORE / TEMPERATURA = Q / T
In questa formula c’è scritto che l’entropia (S) è una quantità di calore (Q) ad una data temperatura (T). Più è grande la quantità di calore (a parità di temperatura), più è grande l’entropia; ma (a parità di quantità di calore) l’entropia diminuisce sempre di più quanto più aumenta la temperatura. E ciò vuol dire che il trasferimento di una data quantità di calore comporta meno entropia se avviene a temperatura più alta. Possiamo allora capire perché si hanno rendimenti maggiori quando le differenze di temperatura tra le due sorgenti (Carnot) sono maggiori; all’aumentare della temperatura della sorgente calda, diminuisce l’entropia associata a quel processo.
In definitiva l’entropia ed il suo aumento rappresentano un fattore di merito delle trasformazioni termodinamiche e possono raccontarci la storia dell’energia che si sta trasformando. L’energia tende ad ‘invecchiare‘ e questo invecchiamento dipende dall’abbassamento di temperatura e dalla conseguente comparsa di calore: più la temperatura, a cui avviene lo scambio di calore, è bassa, più l’energia è invecchiata e più grande è l’entropia.
Abbiamo detto che la tendenza generale della natura è verso un aumento dell’entropia dell’universo. Abbiamo anche detto che questo enunciato ha un carattere probabilistico. Accordiamo meglio le due cose anche per capirne altre che sembrerebbero sfuggire al principio di aumento di entropia e cioè di disordine (in pratica si tratta di capire il senso di quel “in un sistema isolato” che abbiamo letto nell’enunciato dell’aumento dell’entropia).
Pensiamo a quanto avviene nella fecondazione. Degli spermatozoi molto ‘sparpagliati’ interagiscono con degli ovuli. Uno di questi spermatozoi si fa catturare da un ovulo. Comincia la moltiplicazione delle cellule. E poiché possiamo parlare di “uomo“, sappiamo che queste cellule si moltiplicano in modo ordinato tanto da riprodurre un qualcosa che riconosciamo come “uomo“. Si può anzi dire che una delle forme più alte di ordine che noi conosciamo è proprio la vita (le stesse cose si possono dire per una pianta). Ora, va osservato, che la nascita di una vita rappresenta la costruzione di un qualcosa di più ordinato rispetto al qualcosa che la precede, fatto che sembra violare il principio di aumento dell’entropia.
La situazione può essere spiegata pensando al funzionamento di un frigorifero. Questa macchina ha la proprietà di raffreddare: le molecole degli oggetti che vi sono contenuti diminuiscono le loro velocità poiché diminuisce la temperatura; si passa quindi a situazioni più ordinate. Certo, se si prendesse in considerazione solo la cella frigorifera, avremmo ben ragione di buttare via il 2° principio. Ma questo principio, come l’abbiamo noi enunciato, sottolineava che certi processi non avvengono spontaneamente, che cioè bisogna fornire del lavoro dall’esterno per ottenerli, ed inoltre, in altro luogo, esplicitamente diceva “in un sistema isolato“. Ebbene quanto avviene nel frigorifero non avviene spontaneamente proprio perché il sistema non è isolato. C’è un motore dietro, alimentato dalla rete elettrica, e questo motore crea molta più entropia nella cucina di quanta ne riduca la cella frigorifera: in modo che, alla fine, il bilancio è sempre favorevole ad un aumento di entropia (se non credete al fatto che l’entropia creata dal motore è più alta di quella che la cella frigorifera ha ridotto, vuol dire che, chiusa la porta e la finestra della cucina e lasciata aperta la porta del frigorifero, quest’ultimo vi raffredda la cucina come un condizionatore. E quanto questo non sia vero lo sanno tutti quelli che, avendo lasciata aperta la porta del frigorifero, non solo non hanno trovato la cucina più fredda, ma hanno addirittura trovato tutto il contenuto del frigorifero ‘caldo’ – alla temperatura della cucina – e quello del freezer scongelato).
Allo stesso modo per la vita. Essa rappresenta certamente un’isola di violazione del 2° principio perché è un fatto di per sé altamente improbabile, ma è riconducibile al 2° principio proprio in quanto la vita non è possibile in un sistema isolato» Nel sistema uomo – ambiente, la presenza dell’uomo crea un’entropia molto maggiore della riduzione che la sua nascita ha comportato: da uno studio dell’UNESCO risulta che mantenere in vita e in peso un essere umano sano comporta, ogni anno, la degradazione di 500 Kg di cibo e la diffusione nell’ambiente circostante di 2 miliardi di Joule di energia sotto forma termica.
Quanto ora detto apre poi ad un altro interessante capitolo: quello dell’ecologia. Da tutto ciò che abbiamo cercato di spiegare si dovrebbe esser capito che, data 1’inevitabilità dell’aumento dell’entropia, le operazioni: di ‘disinquinamento’ in un dato luogo comportano un inquinamento in un altro (in quello in cui si produce energia per disinquinare; si pensi ad esempio alla grancassa dell’idrogeno: è certamente vero che non inquinerebbe le città ma, nel luogo di sua produzione, creerebbe un gigantesco inquinamento) e, poiché quest’altro luogo si trova sempre sulla Terra, alla lunga non si saprà più dove e come disinquinare. La soluzione di questo problema è un pio desiderio: non si tratta di ‘disinquinare‘ ma di ‘non inquinare‘.
Ma questa è un’altra storia.
Categorie:Senza categoria
Rispondi